新型コロナウイルスの感染対策に有用な室内環境に関連する研究事例の紹介(第一版)
室内環境学会 学術委員会
篠原 直秀 (国立研究開発法人産業技術総合研究所)
【はじめに】
2020年の春時点で、日本を含む世界中で新型コロナウイルス(SARS-CoV-2)の感染が猛威を振るっており、三密を避けることなど、より一層の感染対策が求められています。これまでに数十年の間に、室内環境におけるウイルスへの感染対策に有用な様々な研究が報告されてきました。また、今年に入ってからは新型コロナウイルスについての研究報告も非常に増えています。最新の研究成果は新聞やwebなどで取り上げられることも少なくないため、研究者以外の方も研究成果を目にする機会が増えています。研究者の行った研究の成果は、複数人の著者以外の専門家による査読を経て採用されたものだけが論文として出版されるため、一定程度の信頼性が担保されています。それでも、細かい実験条件の違いで大きく結果の変わるものであったり、前提条件や実験条件等に不備があったりすることで、同様の複数の研究論文において、正反対の結果が示されていることも少なくありません。そのため、ある研究対象について複数の論文を公表されていく内に、研究分野の中で正しい(正しそうな)結論に収束していくことが多いのです。今回の新型コロナウイルスのように緊急の判断を要するような場合には、少ない研究結果も非常に有用で参考にする必要がありますが、長い間研究が積み重ねられてきた研究対象と比べると誤っていたり不確かであったりする場合もあることには注意が必要です。
本稿では、ウイルスの感染経路、飛沫の大きさと室内での飛散、室内空気中での飛沫核の挙動とウイルスの不活化、室内の換気、室内空気の清浄化、室内における沈着と再飛散に関して情報を収集・整理しました。ウイルス一般、飛沫や換気の話などについては、ある程度の期間の多くの研究の蓄積に基づいていますが、特に新型コロナウイルスに関する研究成果については、上述のように、信頼性に対する評価がまだ十分でない結果も多く含まれています。
【ウイルスの感染経路】
現在感染が拡大しているコロナウイルスなどのウイルスは、接触を介した感染と吸入性エアロゾルを介した感染により広がるとされています1)。さらに、新型コロナウイルスの感染経路としても、状況から判断して、接触感染とエアロゾルを介した感染が起きていると考えられています2-6)。接触感染は、握手やハグなどで生じる直接接触によるものと、ドアノブや家電や消費者製品などに触れることにより生じる間接接触によるものに分けられます1)。吸入性エアロゾルを介した感染は、咳やくしゃみや発声に伴って排出される飛沫(主に>5 μmの液滴(μm(マイクロメートル)は、1 mm(ミリメートル)の1000分の1の大きさ))によるもの(いわゆる飛沫感染)と、それらの水分が蒸発して残る飛沫核(<5 μmの粒子)によるもの(いわゆる空気感染)に分けられます1)。本稿では、以下に、飛沫及び飛沫核を介した感染対策に有用だと思われる情報を整理しました。
【飛沫の大きさと室内での飛散】
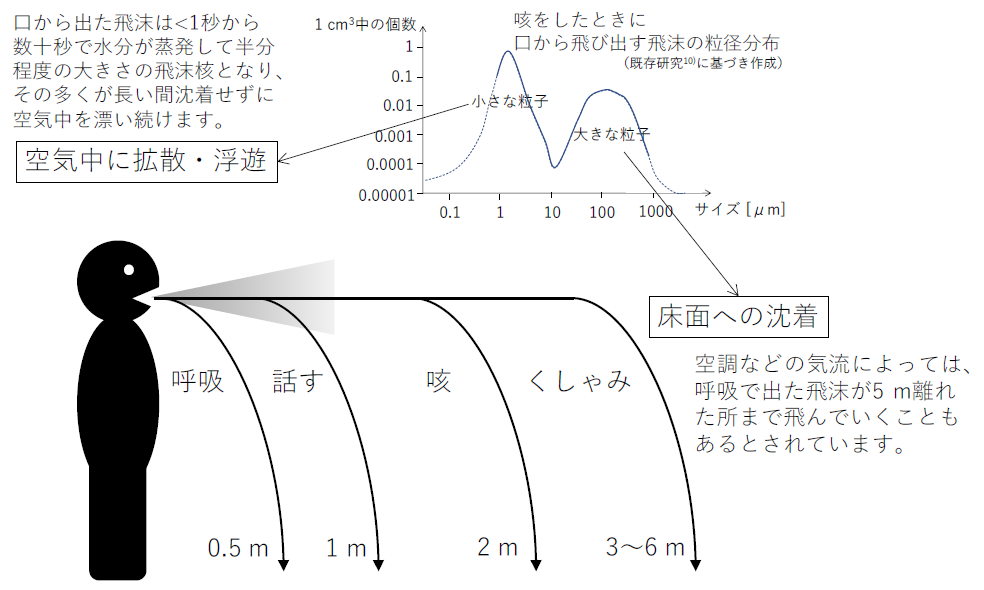
ウイルス自体の大きさは、0.03 μm (リノウイルス7)), 0.08–0.12 μm (インフルエンザウイルス8)), 0.050–0.2 μm (新型コロナウイルス(SARS-CoV-2)9))などとされていますが、それらはさらに大きい飛沫の中に含まれて気中に出てきます。話すときや咳をしたときの呼気中の飛沫の大きさは、0.01 μmから数mm程度であり、個数濃度としては2 μm前後と120–150 μm辺りにピークを持つサイズ分布をしています10)。咳をした時の液滴を0.35 μmから10 μmまで測定したところ、小さい粒子ほど個数が多く、インフルエンザ患者で咳一回当たり75000個/咳、治癒後は咳一回当たり52000個/咳の粒子が含まれていたという報告もあります11)。病院の飛沫中の新型コロナウイルスについては、<1 μmの液滴では検出されず、1–4 μmで>4 μmより高いもしくは同等だったという報告12)、<0.25–>2.5 μmで検出されたものの明らかな粒径分布に関する傾向はなかったという報告13)等がありますが、これらは今のところ査読前原稿であり、また例数も少ないため、今後の知見の集積が待たれるところです。
60 μmを超える大きな飛沫は、通常の呼吸(<1 m/s)では感染者から0.5 m以内、話す場合(<5 m/s)には1 m以内、咳をする場合(<10 m/s)には2 m以内、くしゃみをする場合(20–50 m/s)には3–6 m以内で、重力沈降で床面に沈着して気中からなくなるもしくは水分が蒸発して飛沫核になるとされています14)。これらの研究を元にして、現在多くの国において2 mや6 feet(約1.8 m)のソーシャルディスタンシングを取ることが求められています(2014年のWHOのガイドラインではソーシャルディスタンシングとして最低1 m(3 feet)の距離を取ることを求めています1))。ただし、換気や空調などの室内の気流条件によっては、通常の呼吸をしているだけでも100 μmの飛沫でも感染者から5 m程度まで飛散する可能性もあります15)。
飛沫の水分の蒸発は、0.5–20 μmの粒子では0.8秒16)、50 μmの粒子で2秒、200 μmの粒子でも24秒であり14)、環境中と水分量が平衡となった飛沫核となります。飛沫核は、大部分が糖タンパク質からできており、残りがナトリウム、カリウム、塩素、乳酸塩などからできています17)。また、蒸発後の飛沫核の大きさ(直径)は湿度によって異なるとされており、飛沫を模したNaCl(塩化ナトリウム)の液滴を用いた実験と糖タンパク質を含んでいた場合の推定結果(NaCl液滴と糖タンパクを含む液滴の場合の違いは4%程度しかない)から、相対湿度50%以下では元の飛沫の大きさの40%程度18)、相対湿度90%では元の飛沫の大きさの50%程度になるとされています18)。これらの飛沫核については、一定時間の間、室内空気中を漂うことになります。
2002年に起きたSARSの感染では、飛沫核を介したヒトからヒトの感染も短い距離では生じた可能性はあるものの、主には直接接触もしくは飛沫を介して生じたとされています1)。
【室内空気中での飛沫核の挙動とウイルスの不活化】
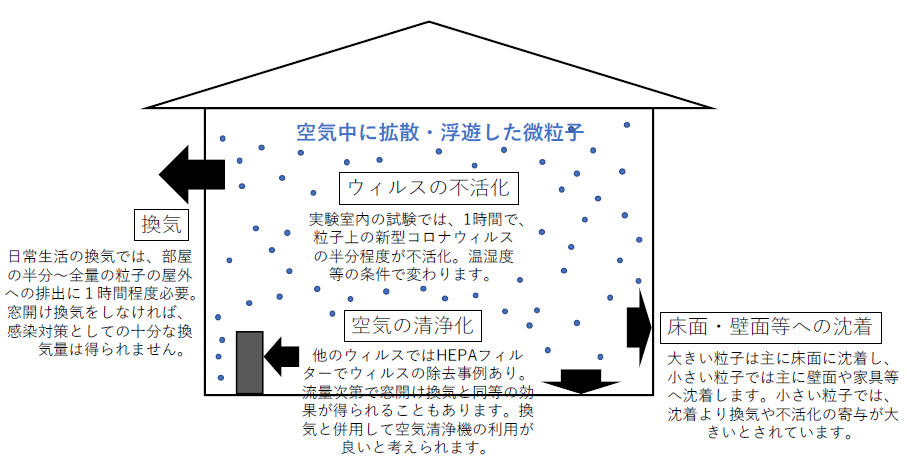
室内におけるエアロゾル中のウイルスは、換気・沈着・不活化によって、感染に寄与しなくなります18)。沈着というのは、重力沈降や気流による慣性や拡散などによって、室内の表面に付着して空気中から除かれることを指しています。相対湿度50%の条件下で咳をした10分後には、1 μm、10 μm、>25 μmのエアロゾル中のインフルエンザウイルスは、重力沈降によって0.7%、51.2%、98.8%減少し、換気によって換気回数1回/h及び10回/hの場合(換気回数の意味については次の項を参照)でサイズに拠らず15%及び81%減少し、不活化によってサイズに拠らず15%減少するという報告があります(それぞれ独立に計算しているため合計は100%を超えていることに注意)18)。つまり、大きい粒子は沈着により空気中から除かれますが、小さい粒子では換気により屋外に排出されるか不活化されるのを待つことになります。エアロゾル中のインフルエンザウイルスは、湿度が高いほど不活化しやすく、また沈着しやすいとされています。相対湿度10%の場合と比べて相対湿度90%の場合では、10分、30分、1時間後に、失活速度は1.4倍、2.7倍、7.3倍に、沈着速度は1.7倍、2.0倍、2.2倍になったという報告もあります18)。実験室(温度22–23°C、相対湿度40%)で発生させたエアロゾル中の新型コロナウイルス(SARS-CoV-2)の生存半減期の中央値は1.1時間(95%信頼区間は0.6–2.6時間)とされています19)。新型コロナウイルスの湿度依存性はよくわかっていませんが、インフルエンザウイルスと比べて、不活化するのにより多くの時間を要する可能性があります。
【室内の換気】
日本の住宅は、建築基準法で新築時に0.5回/h以上の機械換気設備の設置が義務付けられています。換気回数とは、1時間あたり部屋の空気のどのくらいが外気と交換されるかを示すもので、0.5回/hは、1時間で室内の空気の半分が外気と入れ替わることを意味しています。日常生活を送っている一般住宅における換気回数は、春、夏、秋、冬で1.2、1.7、0.6、0.6回/hという報告があり、春や夏で換気回数が高くなっているのは窓開け時間が長いためだとされています20)。海外(中国)の調査でも、窓開け換気をしている住宅としていない住宅では、3.5回/hと0.8回/h(夏季)及び2.5回/hと0.5回/h(年間)と、換気回数に大きな違いがみられています21)。室内で一度のPM2.5発生があった場合には、10分以内の窓開け換気で室内のPM2.5濃度は外気レベル以下に落ちるとされています22)。窓を開けている場合でも、外気の風速と風向や窓の形状によって換気回数は0.5回/hから数10回/hと大きく変わりうることがモデル計算によって報告されており23)、窓開けをしても換気量が大きく上昇しないこともありえます。
MERS患者の病室における感染リスクを評価した研究では、看護師や医療従事者や家族など近くで患者と接する人の感染リスクは、換気回数が6回/hから12回/hに増えても数%しか減らない一方で、同室の離れた場所にいる他の患者のリスクは半分近くまで減少すると推定されています24)。
一般住宅で日常生活を送っている時の換気回数では、数μm以下の粒子に対しては、数十分~数時間曝露され続けることとなります。このことから、定常的もしくは断続的に発生が想定される場合には、常時窓開けをしておくことが望ましいです。ただし、季節や部屋の目的によっては常時の窓開けが困難なケースも考えられます。そのような場合には、一定時間ごとの窓開け換気をすることとなりますが、曝露を減らす対策としては不十分な可能性もあります。
換気によって屋外に排出された空気中にウイルスが含まれている場合も、多くの場合は外気によって非常に高倍率で希釈されるため、屋外での感染には寄与しないと考えられます。ただし、排気口のすぐそばに喫煙所などの人が集まる場所がある場合や、排気口のすぐそばに吸気口がある場合などには、注意が必要なケースもあるかもしれません。
【室内空気の清浄化】
フィルターによる粒径別粒子の捕集効率は、0.1 μm前後で非常に低く、数 μm以上や0.01 μm以下では非常に高いとされています25)。ただし、粒子捕集効率はフィルターによって大きく異なっており、40% ASHRAEフィルター、85% ASHRAEフィルター、標準ファーネスフィルターの粒子捕集効率は、10 nm以下の粒子では、それぞれ40%–100%、40%–100%、100%、数10 nm–数100 nmの粒子で10%以下、20%以下、40%–80%、数 μm以上の粒子では80%–100%、100%、100%だったという報告もあります25)。(ASHRAEは、アメリカ暖房冷凍空調学会のことで、空調システムや換気などに関する各種規格の策定もしている組織です。40%と85%は、研究された当時のASHRAEの規格での粒子の捕集効率と思われます)。静電フィルターでは、これらのサブミクロン領域の低捕集効率が改善され、0.03–0.6 μmの粒子の捕集効率は、市販のHEPAフィルターでそれ以上ではほぼ100%(0.03 μmのみ97%程度、放電状態では40%–90%)、作成したCMフィルターで85%以上(放電状態では30%–80%)、市販のMERV13フィルターで60%以上(放電状態では数%–25%)と向上したとされています26)(HEPAフィルターは、JIS(日本工業規格)で粒径0.3 µmの粒子の捕集効率が99.97%以上とされるフィルターです。CMフィルターはこの研究において作成された市販でない複合素材でのフィルターです。MERVは、米国のフィルターの規格(ASHRAE 52.2 (2007))でMERV 1からMERV 16まであり、MERVE13は0.3–1 μmの粒子の捕集効率が75%以下とされているものです。ちなみに、MERVE16は、0.3–1 μmの粒子の捕集効率が95%以上とされています)。市販の空気清浄機は、数m3/分から10 m3/分のため、HEPAフィルターが搭載されているものであれば、12畳の部屋で3–15回/h程度の換気に相当する可能性があります。HVACシステムでフィルターを通して空気清浄化を行った場合(循環回数0.8–0.9回/h)、咳を模した装置から発生するウイルス(バクテリオファージ T4)の気中濃度は、0.5 m離れた位置では3種類のどのフィルターでも20%程度しか減少せず、3 m離れた位置では20%–80%、5 m離れた位置では70%–98%、12%–92%とフィルターごとに大きく異なる効率で減少します27)(HVACシステムは、暖房・換気・エアコンの機能を一体化したシステム)。HEPAフィルターを搭載した大型の空気清浄化システムを使用した場合(51回/h)、ウイルス(バクテリオファージ MS2)を含むエアロゾル発生器から発生させたウイルスはバクテリアやカビよりは除去効率が低いものの、95%が除去されたとする報告もあります28)。ただし、HEPAフィルターも製品によって性能に違いがあることやウイルスの種類によって効果が小さい場合もありうることには注意が必要です。これらのことから、空気清浄機を使用する場合にも、換気との併用が望ましいと思われます。また、フィルターの取り換え時の曝露が懸念されるため、フィルターの交換は手袋やマスクをした上で、屋外において行うことが望ましいでしょう。
【室内における沈着と再飛散】
大きな粒子では重力沈降により床面に沈着したり移流により壁面に沈着したりすることが多く、小さな粒子では拡散により床面だけでなく天井や壁面や家具などの表面に沈着することが多いとされています。100 μm, 10 μm, 0.1 μmの粒子の床面に沈着する割合は43%–79%、0.6%–18%、2.5%–18%と仮定でき、壁面に沈着する割合は8.7%–47%、51%–86%、51%–89%と仮定できるとしている研究もあります15)。
大きい飛沫は重力沈降により数秒から15秒程度で床面に沈着しますが、小さい粒子はより長時間空気中を漂っています14)。ウイルス(バクテリオファージ T4)の床面への沈着は、大きな大腸菌のケースと違い、咳をした近く(0.5 m)では少なく、3 m離れた位置で高く、5 m離れた地点でも0.5 mの地点より高かったという報告があり27)、感染者から少し離れた場所で床面に沈着する量が多いと思われます。ちなみに、温度21–23°C相対湿度40%の実験室で行った実験では、銅、段ボール紙、ステンレス鋼、プラスチックの表面における新型コロナウイルス(SARS-CoV-2)の不活化の半減期の中央値は、0.77時間、3.5時間、5.6時間、6.8時間とされており、最大では48時間後のステンレス鋼表面(初期値の0.8%)や72時間後のプラスチック表面(初期値の2%)でもウイルスの活性が確認されたとされており19)、沈着後もしばらくは活性を維持していると考えられます。他にも、温度22°C相対湿度65%の実験室において、新型コロナウイルス(SARS-CoV-2)を含む液を表面に滴下したところ、印刷用紙とティッシュペーパでは3時間後まで、木材や布は2日後まで、ガラスや紙幣は4日後まで、ステンレス鋼やプラスチックは7日後まで活性を有していた(初期値の~0.1%)とする報告もあります29)。ただし、これらは実験室内でコントロールされた条件下の試験であり、実環境中では温度・湿度・紫外線の影響をウイルスが受けうることや、ウイルスの活性を調べているがヒトへ感染するかどうかを調べている試験ではない、という点には注意が必要です。実環境における報告では、新型コロナウイルス(SARS-CoV-2)の患者の病室において、ドアノブやベッドレールなどの手の触れるところだけでなく、床や窓や排気ファンなど沈着したと考えられる箇所からもウイルスが検出されています5,12)。室内の床面や各種表面に沈着したウイルスからの接触感染の可能性もあるため、床面やテーブルやドアノブ等の表面について消毒用エタノールや適切に希釈した次亜塩素酸ナトリウム液を使用した殺菌処理を定期的に行うことが必要と考えられます。ただし、次亜塩素酸ナトリウムは、皮膚に対する刺激があり、また消毒した表面に腐食や変色を起こす可能性があります。
室内の床面上のダストは、歩行やドアの開閉や掃除などの人の活動によって再飛散(巻き上げられること)が起こります30)。ダストのサイズ・性状や床面の材質や環境条件によって、再飛散率は大きく異なりますが、金属粒子などのダストの再飛散率は0.000001%–0.1%、カビやバクテリアなどの再飛散率は0.0001%–0.1%とされています30)。再飛散率が高くないためか、ウイルス(バクテリオファージ T4)を用いた試験では、ウイルスが検出された床上を歩いた時に、気中からウイルスは検出されませんでした27)。
【さいごに】
感染者が呼吸・会話・咳・くしゃみなどをすると、ウイルスを含む飛沫が環境中に飛散します。会話や咳で飛散する大きな粒子は、多くの場合2 m以内に床面に沈着しますが、室内の気流によっては5 m程度飛散することもあります。また、飛沫核などの小さな粒子は、沈着せずに数時間もしくはそれ以上室内を漂う可能性もあります。室内空気中からウイルスが除去される経路としては、床面や壁面への沈着、換気による屋外への排出、ウイルスの不活化があります。10 μmを超えるサイズの粒子ではほぼ沈着で除去されますが、数μm以下の粒子では換気と不活化の寄与が大きいと考えられます。室内を漂うエアロゾル上の新型コロナウイルスの不活化の半減期は1.1時間程度という報告があることから、換気をしなければ1時間後でも半分のウイルスは活性を持っている可能性があると考えられます。さらに、日本の一般家屋の日常生活時の換気回数は、春夏で1.2–1.7回/h、秋冬で0.6回/h程度であり、病室などで感染対策として取られる換気回数よりはるかに低いため、室内濃度をより効率的に低減させるためには窓開け換気が推奨されます。ただし、屋外の風向や風速によっては、窓開け換気でも十分な換気量が得られないケースもあると思われます。空気清浄機については、コロナウイルスについての研究はありませんが、ウイルスについては一定の効果が認められているため、有用であると思われますが、換気との併用が望ましいでしょう。マスクについては、感染者からの感染リスク低減に効果があると思われるため、着用が望ましいと考えられますが、それらの研究の整理については、別の機会に譲りたいと思います。また、本稿では対象としませんでしたが、接触感染の防止のために、うがいや手洗いを徹底することが、感染防止の観点からも非常に大事だと考えられます。
※ WHOにおける用語の定義1)
- 接触感染
(contact transmission) 直接接触(direct contact)と間接接触 (indirect contact)による感染(transmission)
- 飛沫感染
(droplet transmission) 主に<1 mの距離で生じる飛沫(droplet)による感染
- 空気感染
(airborne transmission) 飛沫核(droplet nuclei)の飛散・吸入による感染
- 飛沫
(droplet) 5 μmより大きい吸入性エアロゾル
- 飛沫核
(droplet nuclei) 5 μmより小さい吸入性エアロゾルで飛沫が乾燥した吸入性エアロゾル残渣(residue of dried respiratory aerosols)
- 感染性吸入性エアロゾル
(infectious respiratory aerosols) 吸入可能なサイズの感染性の飛沫と飛沫核
【謝辞】本稿は、公開に先駆けて、室内環境学会学術委員会によりコメントをいただき、修正いたしました。学術委員会の川上裕司先生(株式会社エフシージー総合研究所)、清水一男先生(静岡大学)、池田四郎先生(株式会社ガステック)、野﨑淳夫先生(東北文化学園大学大学院)、中島大介先生(国立研究開発法人国立環境研究所)、北條祥子先生(東北大学大学院歯学研究科)、水越厚史先生(近畿大学医学部)、徳村雅弘先生(静岡県立大学)、高木麻衣先生(国立研究開発法人国立環境研究所)、理事会の関根嘉香先生(東海大学)、山口一先生(大同大学)、鍵直樹先生(東京工業大学)、三宅祐一先生(静岡県立大学)に深く感謝申し上げます。
【引用文献】
- World Health Organization: Infection prevention and control of epidemic- and pandemic-prone acute respiratory infections in health care. Geneva: World Health Organization (2014) https://apps.who.int/iris/bitstream/handle/10665/112656/9789241507134_eng.pdf?sequence=1
- Chan J et al.: A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet, 395: 514–523. (2020)
- Li Q et al.: Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia. The New England Journal of Medicine, 382: 1199–1207. (2020)
- Huang C et al. : Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, 395: 497–506. (2020)
- Ong SWX et al.: Air, Surface Environmental, and Personal Protective Equipment Contamination by Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) From a Symptomatic Patient. JAMA, E1–E3 (2020)
- World Health Organization: Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19) 16-24 February 2020. (2020) https://www.who.int/docs/default-source/coronaviruse/who-china-joint-mission-on-covid-19-final-report.pdf
- Bella J et al.: Review: Rhinoviruses and their ICAM receptors. Journal of Structural Biology, 128: 69–74. (1999)
- Noda T: Native morphology of influenza virions. Frontiers in Microbiology, 3: 269. (2012)
- Chen N et al.: Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet, 395: 507-513. (2020)
- Johnson GR et al.: Modality of human expired aerosol size distributions. Journal of Aerosol Science. 42: 839-851. (2011)
- Lindsley WG et al.: Quantity and Size Distribution of Cough-Generated Aerosol Particles Produced by Influenza Patients During and After Illness. Journal of Occupational and Environmental Hygiene, 9: 443–449. (2012)
- Chia PY et al.: Detection of Air and Surface Contamination by Severe Acute Respiratory Syndrome 1 Coronavirus 2 (SARS-CoV-2) in Hospital Rooms of Infected Patients. (Preprint from BioRXiv) (2020) https://doi.org/10.1101/2020.03.29.20046557
- Liu Y et al.: Aerodynamic Characteristics and RNA Concentration of SARS-CoV-2 Aerosol in Wuhan Hospitals during COVID-19 Outbreak. (Preprint from BioRXiv). (2020) https://doi.org/10.1101/2020.03.08.982637
- Xie X et al.: How far droplets can move in indoor environments – revisiting the Wells evaporation–falling curve. Indoor air. 17: 211–225. (2007)
- Chen C and Zhao B: Some questions on dispersion of human exhaled droplets in ventilation room: answers from numerical investigation. Indoor Air, 20: 95-111. (2010)
- Morawska L et al.: Size distribution and sites of origin of droplets expelled from the human respiratory tract during expiratory activities. Journal of Aerosol Science. 40, 256–269. (2009)
- Nicas M et al.: Toward understanding the risk of secondary airborne infection: emission of respirable pathogens, Journal of Occupational and Environmental Hygiene, 2, 143–154. (2005)
- Yang W and Marr LC: Dynamics of Airborne Influenza A Viruses Indoors and Dependence on Humidity. PlosOne, 6: e21481. (2011)
- van Doremalen N et al.: Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England Journal of Medicine (in print) https://www.nejm.org/doi/pdf/10.1056/NEJMc2004973
- Shinohara N et al.: Distribution and variability of the 24-h average air exchange rates and interzonal flow rates in 26 Japanese residences over 5 seasons. Atmospheric Environment, 45: 3548–3552. (2011)
- Hou J et al.: Air change rates at night in northeast Chinese homes. Building and Environment, 132: 273–281. (2018)
- Xiao Y et al.: Effects of source emission and window opening on winter indoor particle concentrations in the severe cold region of China. Building and Environment, 144: 23–33. (2018)
- Wang J et al.: Numerical investigation of single-sided natural ventilation driven by buoyancy and wind through variable window configurations. Energy and Buildings, 168: 147–164. (2018)
- Adhikari U et al.: A Case Study Evaluating the Risk of Infection from Middle Eastern Respiratory Syndrome Coronavirus (MERS-CoV) in a Hospital Setting Through Bioaerosols. Risk Analysis, 39: 2608–2624. (2019)
- Riley WJ et al.: Indoor particulate matter of outdoor origin: Importance of size-dependent removal mechanisms. Environmental Science & Technology, 36: 200–207. (2002)
- Li, S et al.: Effects of relative humidity and particle hygroscopicity on the initial efficiency and aging characteristics of electret HVAC filter media. Building and Environment, 171: 106669. (2020)
- Kunkel SA et al.: Quantifying the size-resolved dynamics of indoor bioaerosol transport and control. Indoor Air, 27: 977–987. (2017)
- Foarde KK et al.: Q Development of a method for measuring single-pass bioaerosol removal efficiencies of a room air cleaner. Aerosol Science and Technology, 30: 223–234. (1999)
- Chin AWH et al.: Stability of SARS-CoV-2 in different environmental conditions. Lancet microbe, (2020) https://doi.org/10.1016/S2666-5247(20)30003-3
- Qian J et al.: Walking-induced particle resuspension in indoor environments. Atmospheric environment, 89: 464–481. (2014)
室内環境学会 学術委員会
篠原 直秀 (国立研究開発法人産業技術総合研究所)
篠原 直秀 (国立研究開発法人産業技術総合研究所)
【はじめに】
2020年の春時点で、日本を含む世界中で新型コロナウイルス(SARS-CoV-2)の感染が猛威を振るっており、三密を避けることなど、より一層の感染対策が求められています。これまでに数十年の間に、室内環境におけるウイルスへの感染対策に有用な様々な研究が報告されてきました。また、今年に入ってからは新型コロナウイルスについての研究報告も非常に増えています。最新の研究成果は新聞やwebなどで取り上げられることも少なくないため、研究者以外の方も研究成果を目にする機会が増えています。研究者の行った研究の成果は、複数人の著者以外の専門家による査読を経て採用されたものだけが論文として出版されるため、一定程度の信頼性が担保されています。それでも、細かい実験条件の違いで大きく結果の変わるものであったり、前提条件や実験条件等に不備があったりすることで、同様の複数の研究論文において、正反対の結果が示されていることも少なくありません。そのため、ある研究対象について複数の論文を公表されていく内に、研究分野の中で正しい(正しそうな)結論に収束していくことが多いのです。今回の新型コロナウイルスのように緊急の判断を要するような場合には、少ない研究結果も非常に有用で参考にする必要がありますが、長い間研究が積み重ねられてきた研究対象と比べると誤っていたり不確かであったりする場合もあることには注意が必要です。
本稿では、ウイルスの感染経路、飛沫の大きさと室内での飛散、室内空気中での飛沫核の挙動とウイルスの不活化、室内の換気、室内空気の清浄化、室内における沈着と再飛散に関して情報を収集・整理しました。ウイルス一般、飛沫や換気の話などについては、ある程度の期間の多くの研究の蓄積に基づいていますが、特に新型コロナウイルスに関する研究成果については、上述のように、信頼性に対する評価がまだ十分でない結果も多く含まれています。
【ウイルスの感染経路】
現在感染が拡大しているコロナウイルスなどのウイルスは、接触を介した感染と吸入性エアロゾルを介した感染により広がるとされています1)。さらに、新型コロナウイルスの感染経路としても、状況から判断して、接触感染とエアロゾルを介した感染が起きていると考えられています2-6)。接触感染は、握手やハグなどで生じる直接接触によるものと、ドアノブや家電や消費者製品などに触れることにより生じる間接接触によるものに分けられます1)。吸入性エアロゾルを介した感染は、咳やくしゃみや発声に伴って排出される飛沫(主に>5 μmの液滴(μm(マイクロメートル)は、1 mm(ミリメートル)の1000分の1の大きさ))によるもの(いわゆる飛沫感染)と、それらの水分が蒸発して残る飛沫核(<5 μmの粒子)によるもの(いわゆる空気感染)に分けられます1)。本稿では、以下に、飛沫及び飛沫核を介した感染対策に有用だと思われる情報を整理しました。
【飛沫の大きさと室内での飛散】
ウイルス自体の大きさは、0.03 μm (リノウイルス7)), 0.08–0.12 μm (インフルエンザウイルス8)), 0.050–0.2 μm (新型コロナウイルス(SARS-CoV-2)9))などとされていますが、それらはさらに大きい飛沫の中に含まれて気中に出てきます。話すときや咳をしたときの呼気中の飛沫の大きさは、0.01 μmから数mm程度であり、個数濃度としては2 μm前後と120–150 μm辺りにピークを持つサイズ分布をしています10)。咳をした時の液滴を0.35 μmから10 μmまで測定したところ、小さい粒子ほど個数が多く、インフルエンザ患者で咳一回当たり75000個/咳、治癒後は咳一回当たり52000個/咳の粒子が含まれていたという報告もあります11)。病院の飛沫中の新型コロナウイルスについては、<1 μmの液滴では検出されず、1–4 μmで>4 μmより高いもしくは同等だったという報告12)、<0.25–>2.5 μmで検出されたものの明らかな粒径分布に関する傾向はなかったという報告13)等がありますが、これらは今のところ査読前原稿であり、また例数も少ないため、今後の知見の集積が待たれるところです。
60 μmを超える大きな飛沫は、通常の呼吸(<1 m/s)では感染者から0.5 m以内、話す場合(<5 m/s)には1 m以内、咳をする場合(<10 m/s)には2 m以内、くしゃみをする場合(20–50 m/s)には3–6 m以内で、重力沈降で床面に沈着して気中からなくなるもしくは水分が蒸発して飛沫核になるとされています14)。これらの研究を元にして、現在多くの国において2 mや6 feet(約1.8 m)のソーシャルディスタンシングを取ることが求められています(2014年のWHOのガイドラインではソーシャルディスタンシングとして最低1 m(3 feet)の距離を取ることを求めています1))。ただし、換気や空調などの室内の気流条件によっては、通常の呼吸をしているだけでも100 μmの飛沫でも感染者から5 m程度まで飛散する可能性もあります15)。
飛沫の水分の蒸発は、0.5–20 μmの粒子では0.8秒16)、50 μmの粒子で2秒、200 μmの粒子でも24秒であり14)、環境中と水分量が平衡となった飛沫核となります。飛沫核は、大部分が糖タンパク質からできており、残りがナトリウム、カリウム、塩素、乳酸塩などからできています17)。また、蒸発後の飛沫核の大きさ(直径)は湿度によって異なるとされており、飛沫を模したNaCl(塩化ナトリウム)の液滴を用いた実験と糖タンパク質を含んでいた場合の推定結果(NaCl液滴と糖タンパクを含む液滴の場合の違いは4%程度しかない)から、相対湿度50%以下では元の飛沫の大きさの40%程度18)、相対湿度90%では元の飛沫の大きさの50%程度になるとされています18)。これらの飛沫核については、一定時間の間、室内空気中を漂うことになります。
2002年に起きたSARSの感染では、飛沫核を介したヒトからヒトの感染も短い距離では生じた可能性はあるものの、主には直接接触もしくは飛沫を介して生じたとされています1)。

【室内空気中での飛沫核の挙動とウイルスの不活化】
室内におけるエアロゾル中のウイルスは、換気・沈着・不活化によって、感染に寄与しなくなります18)。沈着というのは、重力沈降や気流による慣性や拡散などによって、室内の表面に付着して空気中から除かれることを指しています。相対湿度50%の条件下で咳をした10分後には、1 μm、10 μm、>25 μmのエアロゾル中のインフルエンザウイルスは、重力沈降によって0.7%、51.2%、98.8%減少し、換気によって換気回数1回/h及び10回/hの場合(換気回数の意味については次の項を参照)でサイズに拠らず15%及び81%減少し、不活化によってサイズに拠らず15%減少するという報告があります(それぞれ独立に計算しているため合計は100%を超えていることに注意)18)。つまり、大きい粒子は沈着により空気中から除かれますが、小さい粒子では換気により屋外に排出されるか不活化されるのを待つことになります。エアロゾル中のインフルエンザウイルスは、湿度が高いほど不活化しやすく、また沈着しやすいとされています。相対湿度10%の場合と比べて相対湿度90%の場合では、10分、30分、1時間後に、失活速度は1.4倍、2.7倍、7.3倍に、沈着速度は1.7倍、2.0倍、2.2倍になったという報告もあります18)。実験室(温度22–23°C、相対湿度40%)で発生させたエアロゾル中の新型コロナウイルス(SARS-CoV-2)の生存半減期の中央値は1.1時間(95%信頼区間は0.6–2.6時間)とされています19)。新型コロナウイルスの湿度依存性はよくわかっていませんが、インフルエンザウイルスと比べて、不活化するのにより多くの時間を要する可能性があります。
【室内の換気】
日本の住宅は、建築基準法で新築時に0.5回/h以上の機械換気設備の設置が義務付けられています。換気回数とは、1時間あたり部屋の空気のどのくらいが外気と交換されるかを示すもので、0.5回/hは、1時間で室内の空気の半分が外気と入れ替わることを意味しています。日常生活を送っている一般住宅における換気回数は、春、夏、秋、冬で1.2、1.7、0.6、0.6回/hという報告があり、春や夏で換気回数が高くなっているのは窓開け時間が長いためだとされています20)。海外(中国)の調査でも、窓開け換気をしている住宅としていない住宅では、3.5回/hと0.8回/h(夏季)及び2.5回/hと0.5回/h(年間)と、換気回数に大きな違いがみられています21)。室内で一度のPM2.5発生があった場合には、10分以内の窓開け換気で室内のPM2.5濃度は外気レベル以下に落ちるとされています22)。窓を開けている場合でも、外気の風速と風向や窓の形状によって換気回数は0.5回/hから数10回/hと大きく変わりうることがモデル計算によって報告されており23)、窓開けをしても換気量が大きく上昇しないこともありえます。
MERS患者の病室における感染リスクを評価した研究では、看護師や医療従事者や家族など近くで患者と接する人の感染リスクは、換気回数が6回/hから12回/hに増えても数%しか減らない一方で、同室の離れた場所にいる他の患者のリスクは半分近くまで減少すると推定されています24)。
一般住宅で日常生活を送っている時の換気回数では、数μm以下の粒子に対しては、数十分~数時間曝露され続けることとなります。このことから、定常的もしくは断続的に発生が想定される場合には、常時窓開けをしておくことが望ましいです。ただし、季節や部屋の目的によっては常時の窓開けが困難なケースも考えられます。そのような場合には、一定時間ごとの窓開け換気をすることとなりますが、曝露を減らす対策としては不十分な可能性もあります。
換気によって屋外に排出された空気中にウイルスが含まれている場合も、多くの場合は外気によって非常に高倍率で希釈されるため、屋外での感染には寄与しないと考えられます。ただし、排気口のすぐそばに喫煙所などの人が集まる場所がある場合や、排気口のすぐそばに吸気口がある場合などには、注意が必要なケースもあるかもしれません。
【室内空気の清浄化】
フィルターによる粒径別粒子の捕集効率は、0.1 μm前後で非常に低く、数 μm以上や0.01 μm以下では非常に高いとされています25)。ただし、粒子捕集効率はフィルターによって大きく異なっており、40% ASHRAEフィルター、85% ASHRAEフィルター、標準ファーネスフィルターの粒子捕集効率は、10 nm以下の粒子では、それぞれ40%–100%、40%–100%、100%、数10 nm–数100 nmの粒子で10%以下、20%以下、40%–80%、数 μm以上の粒子では80%–100%、100%、100%だったという報告もあります25)。(ASHRAEは、アメリカ暖房冷凍空調学会のことで、空調システムや換気などに関する各種規格の策定もしている組織です。40%と85%は、研究された当時のASHRAEの規格での粒子の捕集効率と思われます)。静電フィルターでは、これらのサブミクロン領域の低捕集効率が改善され、0.03–0.6 μmの粒子の捕集効率は、市販のHEPAフィルターでそれ以上ではほぼ100%(0.03 μmのみ97%程度、放電状態では40%–90%)、作成したCMフィルターで85%以上(放電状態では30%–80%)、市販のMERV13フィルターで60%以上(放電状態では数%–25%)と向上したとされています26)(HEPAフィルターは、JIS(日本工業規格)で粒径0.3 µmの粒子の捕集効率が99.97%以上とされるフィルターです。CMフィルターはこの研究において作成された市販でない複合素材でのフィルターです。MERVは、米国のフィルターの規格(ASHRAE 52.2 (2007))でMERV 1からMERV 16まであり、MERVE13は0.3–1 μmの粒子の捕集効率が75%以下とされているものです。ちなみに、MERVE16は、0.3–1 μmの粒子の捕集効率が95%以上とされています)。市販の空気清浄機は、数m3/分から10 m3/分のため、HEPAフィルターが搭載されているものであれば、12畳の部屋で3–15回/h程度の換気に相当する可能性があります。HVACシステムでフィルターを通して空気清浄化を行った場合(循環回数0.8–0.9回/h)、咳を模した装置から発生するウイルス(バクテリオファージ T4)の気中濃度は、0.5 m離れた位置では3種類のどのフィルターでも20%程度しか減少せず、3 m離れた位置では20%–80%、5 m離れた位置では70%–98%、12%–92%とフィルターごとに大きく異なる効率で減少します27)(HVACシステムは、暖房・換気・エアコンの機能を一体化したシステム)。HEPAフィルターを搭載した大型の空気清浄化システムを使用した場合(51回/h)、ウイルス(バクテリオファージ MS2)を含むエアロゾル発生器から発生させたウイルスはバクテリアやカビよりは除去効率が低いものの、95%が除去されたとする報告もあります28)。ただし、HEPAフィルターも製品によって性能に違いがあることやウイルスの種類によって効果が小さい場合もありうることには注意が必要です。これらのことから、空気清浄機を使用する場合にも、換気との併用が望ましいと思われます。また、フィルターの取り換え時の曝露が懸念されるため、フィルターの交換は手袋やマスクをした上で、屋外において行うことが望ましいでしょう。
【室内における沈着と再飛散】
大きな粒子では重力沈降により床面に沈着したり移流により壁面に沈着したりすることが多く、小さな粒子では拡散により床面だけでなく天井や壁面や家具などの表面に沈着することが多いとされています。100 μm, 10 μm, 0.1 μmの粒子の床面に沈着する割合は43%–79%、0.6%–18%、2.5%–18%と仮定でき、壁面に沈着する割合は8.7%–47%、51%–86%、51%–89%と仮定できるとしている研究もあります15)。
大きい飛沫は重力沈降により数秒から15秒程度で床面に沈着しますが、小さい粒子はより長時間空気中を漂っています14)。ウイルス(バクテリオファージ T4)の床面への沈着は、大きな大腸菌のケースと違い、咳をした近く(0.5 m)では少なく、3 m離れた位置で高く、5 m離れた地点でも0.5 mの地点より高かったという報告があり27)、感染者から少し離れた場所で床面に沈着する量が多いと思われます。ちなみに、温度21–23°C相対湿度40%の実験室で行った実験では、銅、段ボール紙、ステンレス鋼、プラスチックの表面における新型コロナウイルス(SARS-CoV-2)の不活化の半減期の中央値は、0.77時間、3.5時間、5.6時間、6.8時間とされており、最大では48時間後のステンレス鋼表面(初期値の0.8%)や72時間後のプラスチック表面(初期値の2%)でもウイルスの活性が確認されたとされており19)、沈着後もしばらくは活性を維持していると考えられます。他にも、温度22°C相対湿度65%の実験室において、新型コロナウイルス(SARS-CoV-2)を含む液を表面に滴下したところ、印刷用紙とティッシュペーパでは3時間後まで、木材や布は2日後まで、ガラスや紙幣は4日後まで、ステンレス鋼やプラスチックは7日後まで活性を有していた(初期値の~0.1%)とする報告もあります29)。ただし、これらは実験室内でコントロールされた条件下の試験であり、実環境中では温度・湿度・紫外線の影響をウイルスが受けうることや、ウイルスの活性を調べているがヒトへ感染するかどうかを調べている試験ではない、という点には注意が必要です。実環境における報告では、新型コロナウイルス(SARS-CoV-2)の患者の病室において、ドアノブやベッドレールなどの手の触れるところだけでなく、床や窓や排気ファンなど沈着したと考えられる箇所からもウイルスが検出されています5,12)。室内の床面や各種表面に沈着したウイルスからの接触感染の可能性もあるため、床面やテーブルやドアノブ等の表面について消毒用エタノールや適切に希釈した次亜塩素酸ナトリウム液を使用した殺菌処理を定期的に行うことが必要と考えられます。ただし、次亜塩素酸ナトリウムは、皮膚に対する刺激があり、また消毒した表面に腐食や変色を起こす可能性があります。
室内の床面上のダストは、歩行やドアの開閉や掃除などの人の活動によって再飛散(巻き上げられること)が起こります30)。ダストのサイズ・性状や床面の材質や環境条件によって、再飛散率は大きく異なりますが、金属粒子などのダストの再飛散率は0.000001%–0.1%、カビやバクテリアなどの再飛散率は0.0001%–0.1%とされています30)。再飛散率が高くないためか、ウイルス(バクテリオファージ T4)を用いた試験では、ウイルスが検出された床上を歩いた時に、気中からウイルスは検出されませんでした27)。

【さいごに】
感染者が呼吸・会話・咳・くしゃみなどをすると、ウイルスを含む飛沫が環境中に飛散します。会話や咳で飛散する大きな粒子は、多くの場合2 m以内に床面に沈着しますが、室内の気流によっては5 m程度飛散することもあります。また、飛沫核などの小さな粒子は、沈着せずに数時間もしくはそれ以上室内を漂う可能性もあります。室内空気中からウイルスが除去される経路としては、床面や壁面への沈着、換気による屋外への排出、ウイルスの不活化があります。10 μmを超えるサイズの粒子ではほぼ沈着で除去されますが、数μm以下の粒子では換気と不活化の寄与が大きいと考えられます。室内を漂うエアロゾル上の新型コロナウイルスの不活化の半減期は1.1時間程度という報告があることから、換気をしなければ1時間後でも半分のウイルスは活性を持っている可能性があると考えられます。さらに、日本の一般家屋の日常生活時の換気回数は、春夏で1.2–1.7回/h、秋冬で0.6回/h程度であり、病室などで感染対策として取られる換気回数よりはるかに低いため、室内濃度をより効率的に低減させるためには窓開け換気が推奨されます。ただし、屋外の風向や風速によっては、窓開け換気でも十分な換気量が得られないケースもあると思われます。空気清浄機については、コロナウイルスについての研究はありませんが、ウイルスについては一定の効果が認められているため、有用であると思われますが、換気との併用が望ましいでしょう。マスクについては、感染者からの感染リスク低減に効果があると思われるため、着用が望ましいと考えられますが、それらの研究の整理については、別の機会に譲りたいと思います。また、本稿では対象としませんでしたが、接触感染の防止のために、うがいや手洗いを徹底することが、感染防止の観点からも非常に大事だと考えられます。
※ WHOにおける用語の定義1)
- 接触感染
(contact transmission) 直接接触(direct contact)と間接接触 (indirect contact)による感染(transmission)
- 飛沫感染
(droplet transmission) 主に<1 mの距離で生じる飛沫(droplet)による感染
- 空気感染
(airborne transmission) 飛沫核(droplet nuclei)の飛散・吸入による感染
- 飛沫
(droplet) 5 μmより大きい吸入性エアロゾル
- 飛沫核
(droplet nuclei) 5 μmより小さい吸入性エアロゾルで飛沫が乾燥した吸入性エアロゾル残渣(residue of dried respiratory aerosols)
- 感染性吸入性エアロゾル
(infectious respiratory aerosols) 吸入可能なサイズの感染性の飛沫と飛沫核
【謝辞】本稿は、公開に先駆けて、室内環境学会学術委員会によりコメントをいただき、修正いたしました。学術委員会の川上裕司先生(株式会社エフシージー総合研究所)、清水一男先生(静岡大学)、池田四郎先生(株式会社ガステック)、野﨑淳夫先生(東北文化学園大学大学院)、中島大介先生(国立研究開発法人国立環境研究所)、北條祥子先生(東北大学大学院歯学研究科)、水越厚史先生(近畿大学医学部)、徳村雅弘先生(静岡県立大学)、高木麻衣先生(国立研究開発法人国立環境研究所)、理事会の関根嘉香先生(東海大学)、山口一先生(大同大学)、鍵直樹先生(東京工業大学)、三宅祐一先生(静岡県立大学)に深く感謝申し上げます。
【引用文献】
- World Health Organization: Infection prevention and control of epidemic- and pandemic-prone acute respiratory infections in health care. Geneva: World Health Organization (2014) https://apps.who.int/iris/bitstream/handle/10665/112656/9789241507134_eng.pdf?sequence=1
- Chan J et al.: A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet, 395: 514–523. (2020)
- Li Q et al.: Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia. The New England Journal of Medicine, 382: 1199–1207. (2020)
- Huang C et al. : Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, 395: 497–506. (2020)
- Ong SWX et al.: Air, Surface Environmental, and Personal Protective Equipment Contamination by Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) From a Symptomatic Patient. JAMA, E1–E3 (2020)
- World Health Organization: Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19) 16-24 February 2020. (2020) https://www.who.int/docs/default-source/coronaviruse/who-china-joint-mission-on-covid-19-final-report.pdf
- Bella J et al.: Review: Rhinoviruses and their ICAM receptors. Journal of Structural Biology, 128: 69–74. (1999)
- Noda T: Native morphology of influenza virions. Frontiers in Microbiology, 3: 269. (2012)
- Chen N et al.: Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet, 395: 507-513. (2020)
- Johnson GR et al.: Modality of human expired aerosol size distributions. Journal of Aerosol Science. 42: 839-851. (2011)
- Lindsley WG et al.: Quantity and Size Distribution of Cough-Generated Aerosol Particles Produced by Influenza Patients During and After Illness. Journal of Occupational and Environmental Hygiene, 9: 443–449. (2012)
- Chia PY et al.: Detection of Air and Surface Contamination by Severe Acute Respiratory Syndrome 1 Coronavirus 2 (SARS-CoV-2) in Hospital Rooms of Infected Patients. (Preprint from BioRXiv) (2020) https://doi.org/10.1101/2020.03.29.20046557
- Liu Y et al.: Aerodynamic Characteristics and RNA Concentration of SARS-CoV-2 Aerosol in Wuhan Hospitals during COVID-19 Outbreak. (Preprint from BioRXiv). (2020) https://doi.org/10.1101/2020.03.08.982637
- Xie X et al.: How far droplets can move in indoor environments – revisiting the Wells evaporation–falling curve. Indoor air. 17: 211–225. (2007)
- Chen C and Zhao B: Some questions on dispersion of human exhaled droplets in ventilation room: answers from numerical investigation. Indoor Air, 20: 95-111. (2010)
- Morawska L et al.: Size distribution and sites of origin of droplets expelled from the human respiratory tract during expiratory activities. Journal of Aerosol Science. 40, 256–269. (2009)
- Nicas M et al.: Toward understanding the risk of secondary airborne infection: emission of respirable pathogens, Journal of Occupational and Environmental Hygiene, 2, 143–154. (2005)
- Yang W and Marr LC: Dynamics of Airborne Influenza A Viruses Indoors and Dependence on Humidity. PlosOne, 6: e21481. (2011)
- van Doremalen N et al.: Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England Journal of Medicine (in print) https://www.nejm.org/doi/pdf/10.1056/NEJMc2004973
- Shinohara N et al.: Distribution and variability of the 24-h average air exchange rates and interzonal flow rates in 26 Japanese residences over 5 seasons. Atmospheric Environment, 45: 3548–3552. (2011)
- Hou J et al.: Air change rates at night in northeast Chinese homes. Building and Environment, 132: 273–281. (2018)
- Xiao Y et al.: Effects of source emission and window opening on winter indoor particle concentrations in the severe cold region of China. Building and Environment, 144: 23–33. (2018)
- Wang J et al.: Numerical investigation of single-sided natural ventilation driven by buoyancy and wind through variable window configurations. Energy and Buildings, 168: 147–164. (2018)
- Adhikari U et al.: A Case Study Evaluating the Risk of Infection from Middle Eastern Respiratory Syndrome Coronavirus (MERS-CoV) in a Hospital Setting Through Bioaerosols. Risk Analysis, 39: 2608–2624. (2019)
- Riley WJ et al.: Indoor particulate matter of outdoor origin: Importance of size-dependent removal mechanisms. Environmental Science & Technology, 36: 200–207. (2002)
- Li, S et al.: Effects of relative humidity and particle hygroscopicity on the initial efficiency and aging characteristics of electret HVAC filter media. Building and Environment, 171: 106669. (2020)
- Kunkel SA et al.: Quantifying the size-resolved dynamics of indoor bioaerosol transport and control. Indoor Air, 27: 977–987. (2017)
- Foarde KK et al.: Q Development of a method for measuring single-pass bioaerosol removal efficiencies of a room air cleaner. Aerosol Science and Technology, 30: 223–234. (1999)
- Chin AWH et al.: Stability of SARS-CoV-2 in different environmental conditions. Lancet microbe, (2020) https://doi.org/10.1016/S2666-5247(20)30003-3
- Qian J et al.: Walking-induced particle resuspension in indoor environments. Atmospheric environment, 89: 464–481. (2014)
2020年の春時点で、日本を含む世界中で新型コロナウイルス(SARS-CoV-2)の感染が猛威を振るっており、三密を避けることなど、より一層の感染対策が求められています。これまでに数十年の間に、室内環境におけるウイルスへの感染対策に有用な様々な研究が報告されてきました。また、今年に入ってからは新型コロナウイルスについての研究報告も非常に増えています。最新の研究成果は新聞やwebなどで取り上げられることも少なくないため、研究者以外の方も研究成果を目にする機会が増えています。研究者の行った研究の成果は、複数人の著者以外の専門家による査読を経て採用されたものだけが論文として出版されるため、一定程度の信頼性が担保されています。それでも、細かい実験条件の違いで大きく結果の変わるものであったり、前提条件や実験条件等に不備があったりすることで、同様の複数の研究論文において、正反対の結果が示されていることも少なくありません。そのため、ある研究対象について複数の論文を公表されていく内に、研究分野の中で正しい(正しそうな)結論に収束していくことが多いのです。今回の新型コロナウイルスのように緊急の判断を要するような場合には、少ない研究結果も非常に有用で参考にする必要がありますが、長い間研究が積み重ねられてきた研究対象と比べると誤っていたり不確かであったりする場合もあることには注意が必要です。
本稿では、ウイルスの感染経路、飛沫の大きさと室内での飛散、室内空気中での飛沫核の挙動とウイルスの不活化、室内の換気、室内空気の清浄化、室内における沈着と再飛散に関して情報を収集・整理しました。ウイルス一般、飛沫や換気の話などについては、ある程度の期間の多くの研究の蓄積に基づいていますが、特に新型コロナウイルスに関する研究成果については、上述のように、信頼性に対する評価がまだ十分でない結果も多く含まれています。
本稿では、ウイルスの感染経路、飛沫の大きさと室内での飛散、室内空気中での飛沫核の挙動とウイルスの不活化、室内の換気、室内空気の清浄化、室内における沈着と再飛散に関して情報を収集・整理しました。ウイルス一般、飛沫や換気の話などについては、ある程度の期間の多くの研究の蓄積に基づいていますが、特に新型コロナウイルスに関する研究成果については、上述のように、信頼性に対する評価がまだ十分でない結果も多く含まれています。
【ウイルスの感染経路】
現在感染が拡大しているコロナウイルスなどのウイルスは、接触を介した感染と吸入性エアロゾルを介した感染により広がるとされています1)。さらに、新型コロナウイルスの感染経路としても、状況から判断して、接触感染とエアロゾルを介した感染が起きていると考えられています2-6)。接触感染は、握手やハグなどで生じる直接接触によるものと、ドアノブや家電や消費者製品などに触れることにより生じる間接接触によるものに分けられます1)。吸入性エアロゾルを介した感染は、咳やくしゃみや発声に伴って排出される飛沫(主に>5 μmの液滴(μm(マイクロメートル)は、1 mm(ミリメートル)の1000分の1の大きさ))によるもの(いわゆる飛沫感染)と、それらの水分が蒸発して残る飛沫核(<5 μmの粒子)によるもの(いわゆる空気感染)に分けられます1)。本稿では、以下に、飛沫及び飛沫核を介した感染対策に有用だと思われる情報を整理しました。
【飛沫の大きさと室内での飛散】
ウイルス自体の大きさは、0.03 μm (リノウイルス7)), 0.08–0.12 μm (インフルエンザウイルス8)), 0.050–0.2 μm (新型コロナウイルス(SARS-CoV-2)9))などとされていますが、それらはさらに大きい飛沫の中に含まれて気中に出てきます。話すときや咳をしたときの呼気中の飛沫の大きさは、0.01 μmから数mm程度であり、個数濃度としては2 μm前後と120–150 μm辺りにピークを持つサイズ分布をしています10)。咳をした時の液滴を0.35 μmから10 μmまで測定したところ、小さい粒子ほど個数が多く、インフルエンザ患者で咳一回当たり75000個/咳、治癒後は咳一回当たり52000個/咳の粒子が含まれていたという報告もあります11)。病院の飛沫中の新型コロナウイルスについては、<1 μmの液滴では検出されず、1–4 μmで>4 μmより高いもしくは同等だったという報告12)、<0.25–>2.5 μmで検出されたものの明らかな粒径分布に関する傾向はなかったという報告13)等がありますが、これらは今のところ査読前原稿であり、また例数も少ないため、今後の知見の集積が待たれるところです。
60 μmを超える大きな飛沫は、通常の呼吸(<1 m/s)では感染者から0.5 m以内、話す場合(<5 m/s)には1 m以内、咳をする場合(<10 m/s)には2 m以内、くしゃみをする場合(20–50 m/s)には3–6 m以内で、重力沈降で床面に沈着して気中からなくなるもしくは水分が蒸発して飛沫核になるとされています14)。これらの研究を元にして、現在多くの国において2 mや6 feet(約1.8 m)のソーシャルディスタンシングを取ることが求められています(2014年のWHOのガイドラインではソーシャルディスタンシングとして最低1 m(3 feet)の距離を取ることを求めています1))。ただし、換気や空調などの室内の気流条件によっては、通常の呼吸をしているだけでも100 μmの飛沫でも感染者から5 m程度まで飛散する可能性もあります15)。
飛沫の水分の蒸発は、0.5–20 μmの粒子では0.8秒16)、50 μmの粒子で2秒、200 μmの粒子でも24秒であり14)、環境中と水分量が平衡となった飛沫核となります。飛沫核は、大部分が糖タンパク質からできており、残りがナトリウム、カリウム、塩素、乳酸塩などからできています17)。また、蒸発後の飛沫核の大きさ(直径)は湿度によって異なるとされており、飛沫を模したNaCl(塩化ナトリウム)の液滴を用いた実験と糖タンパク質を含んでいた場合の推定結果(NaCl液滴と糖タンパクを含む液滴の場合の違いは4%程度しかない)から、相対湿度50%以下では元の飛沫の大きさの40%程度18)、相対湿度90%では元の飛沫の大きさの50%程度になるとされています18)。これらの飛沫核については、一定時間の間、室内空気中を漂うことになります。
2002年に起きたSARSの感染では、飛沫核を介したヒトからヒトの感染も短い距離では生じた可能性はあるものの、主には直接接触もしくは飛沫を介して生じたとされています1)。

【室内空気中での飛沫核の挙動とウイルスの不活化】
室内におけるエアロゾル中のウイルスは、換気・沈着・不活化によって、感染に寄与しなくなります18)。沈着というのは、重力沈降や気流による慣性や拡散などによって、室内の表面に付着して空気中から除かれることを指しています。相対湿度50%の条件下で咳をした10分後には、1 μm、10 μm、>25 μmのエアロゾル中のインフルエンザウイルスは、重力沈降によって0.7%、51.2%、98.8%減少し、換気によって換気回数1回/h及び10回/hの場合(換気回数の意味については次の項を参照)でサイズに拠らず15%及び81%減少し、不活化によってサイズに拠らず15%減少するという報告があります(それぞれ独立に計算しているため合計は100%を超えていることに注意)18)。つまり、大きい粒子は沈着により空気中から除かれますが、小さい粒子では換気により屋外に排出されるか不活化されるのを待つことになります。エアロゾル中のインフルエンザウイルスは、湿度が高いほど不活化しやすく、また沈着しやすいとされています。相対湿度10%の場合と比べて相対湿度90%の場合では、10分、30分、1時間後に、失活速度は1.4倍、2.7倍、7.3倍に、沈着速度は1.7倍、2.0倍、2.2倍になったという報告もあります18)。実験室(温度22–23°C、相対湿度40%)で発生させたエアロゾル中の新型コロナウイルス(SARS-CoV-2)の生存半減期の中央値は1.1時間(95%信頼区間は0.6–2.6時間)とされています19)。新型コロナウイルスの湿度依存性はよくわかっていませんが、インフルエンザウイルスと比べて、不活化するのにより多くの時間を要する可能性があります。
【室内の換気】
日本の住宅は、建築基準法で新築時に0.5回/h以上の機械換気設備の設置が義務付けられています。換気回数とは、1時間あたり部屋の空気のどのくらいが外気と交換されるかを示すもので、0.5回/hは、1時間で室内の空気の半分が外気と入れ替わることを意味しています。日常生活を送っている一般住宅における換気回数は、春、夏、秋、冬で1.2、1.7、0.6、0.6回/hという報告があり、春や夏で換気回数が高くなっているのは窓開け時間が長いためだとされています20)。海外(中国)の調査でも、窓開け換気をしている住宅としていない住宅では、3.5回/hと0.8回/h(夏季)及び2.5回/hと0.5回/h(年間)と、換気回数に大きな違いがみられています21)。室内で一度のPM2.5発生があった場合には、10分以内の窓開け換気で室内のPM2.5濃度は外気レベル以下に落ちるとされています22)。窓を開けている場合でも、外気の風速と風向や窓の形状によって換気回数は0.5回/hから数10回/hと大きく変わりうることがモデル計算によって報告されており23)、窓開けをしても換気量が大きく上昇しないこともありえます。
MERS患者の病室における感染リスクを評価した研究では、看護師や医療従事者や家族など近くで患者と接する人の感染リスクは、換気回数が6回/hから12回/hに増えても数%しか減らない一方で、同室の離れた場所にいる他の患者のリスクは半分近くまで減少すると推定されています24)。
一般住宅で日常生活を送っている時の換気回数では、数μm以下の粒子に対しては、数十分~数時間曝露され続けることとなります。このことから、定常的もしくは断続的に発生が想定される場合には、常時窓開けをしておくことが望ましいです。ただし、季節や部屋の目的によっては常時の窓開けが困難なケースも考えられます。そのような場合には、一定時間ごとの窓開け換気をすることとなりますが、曝露を減らす対策としては不十分な可能性もあります。
換気によって屋外に排出された空気中にウイルスが含まれている場合も、多くの場合は外気によって非常に高倍率で希釈されるため、屋外での感染には寄与しないと考えられます。ただし、排気口のすぐそばに喫煙所などの人が集まる場所がある場合や、排気口のすぐそばに吸気口がある場合などには、注意が必要なケースもあるかもしれません。
【室内空気の清浄化】
フィルターによる粒径別粒子の捕集効率は、0.1 μm前後で非常に低く、数 μm以上や0.01 μm以下では非常に高いとされています25)。ただし、粒子捕集効率はフィルターによって大きく異なっており、40% ASHRAEフィルター、85% ASHRAEフィルター、標準ファーネスフィルターの粒子捕集効率は、10 nm以下の粒子では、それぞれ40%–100%、40%–100%、100%、数10 nm–数100 nmの粒子で10%以下、20%以下、40%–80%、数 μm以上の粒子では80%–100%、100%、100%だったという報告もあります25)。(ASHRAEは、アメリカ暖房冷凍空調学会のことで、空調システムや換気などに関する各種規格の策定もしている組織です。40%と85%は、研究された当時のASHRAEの規格での粒子の捕集効率と思われます)。静電フィルターでは、これらのサブミクロン領域の低捕集効率が改善され、0.03–0.6 μmの粒子の捕集効率は、市販のHEPAフィルターでそれ以上ではほぼ100%(0.03 μmのみ97%程度、放電状態では40%–90%)、作成したCMフィルターで85%以上(放電状態では30%–80%)、市販のMERV13フィルターで60%以上(放電状態では数%–25%)と向上したとされています26)(HEPAフィルターは、JIS(日本工業規格)で粒径0.3 µmの粒子の捕集効率が99.97%以上とされるフィルターです。CMフィルターはこの研究において作成された市販でない複合素材でのフィルターです。MERVは、米国のフィルターの規格(ASHRAE 52.2 (2007))でMERV 1からMERV 16まであり、MERVE13は0.3–1 μmの粒子の捕集効率が75%以下とされているものです。ちなみに、MERVE16は、0.3–1 μmの粒子の捕集効率が95%以上とされています)。市販の空気清浄機は、数m3/分から10 m3/分のため、HEPAフィルターが搭載されているものであれば、12畳の部屋で3–15回/h程度の換気に相当する可能性があります。HVACシステムでフィルターを通して空気清浄化を行った場合(循環回数0.8–0.9回/h)、咳を模した装置から発生するウイルス(バクテリオファージ T4)の気中濃度は、0.5 m離れた位置では3種類のどのフィルターでも20%程度しか減少せず、3 m離れた位置では20%–80%、5 m離れた位置では70%–98%、12%–92%とフィルターごとに大きく異なる効率で減少します27)(HVACシステムは、暖房・換気・エアコンの機能を一体化したシステム)。HEPAフィルターを搭載した大型の空気清浄化システムを使用した場合(51回/h)、ウイルス(バクテリオファージ MS2)を含むエアロゾル発生器から発生させたウイルスはバクテリアやカビよりは除去効率が低いものの、95%が除去されたとする報告もあります28)。ただし、HEPAフィルターも製品によって性能に違いがあることやウイルスの種類によって効果が小さい場合もありうることには注意が必要です。これらのことから、空気清浄機を使用する場合にも、換気との併用が望ましいと思われます。また、フィルターの取り換え時の曝露が懸念されるため、フィルターの交換は手袋やマスクをした上で、屋外において行うことが望ましいでしょう。
【室内における沈着と再飛散】
大きな粒子では重力沈降により床面に沈着したり移流により壁面に沈着したりすることが多く、小さな粒子では拡散により床面だけでなく天井や壁面や家具などの表面に沈着することが多いとされています。100 μm, 10 μm, 0.1 μmの粒子の床面に沈着する割合は43%–79%、0.6%–18%、2.5%–18%と仮定でき、壁面に沈着する割合は8.7%–47%、51%–86%、51%–89%と仮定できるとしている研究もあります15)。
大きい飛沫は重力沈降により数秒から15秒程度で床面に沈着しますが、小さい粒子はより長時間空気中を漂っています14)。ウイルス(バクテリオファージ T4)の床面への沈着は、大きな大腸菌のケースと違い、咳をした近く(0.5 m)では少なく、3 m離れた位置で高く、5 m離れた地点でも0.5 mの地点より高かったという報告があり27)、感染者から少し離れた場所で床面に沈着する量が多いと思われます。ちなみに、温度21–23°C相対湿度40%の実験室で行った実験では、銅、段ボール紙、ステンレス鋼、プラスチックの表面における新型コロナウイルス(SARS-CoV-2)の不活化の半減期の中央値は、0.77時間、3.5時間、5.6時間、6.8時間とされており、最大では48時間後のステンレス鋼表面(初期値の0.8%)や72時間後のプラスチック表面(初期値の2%)でもウイルスの活性が確認されたとされており19)、沈着後もしばらくは活性を維持していると考えられます。他にも、温度22°C相対湿度65%の実験室において、新型コロナウイルス(SARS-CoV-2)を含む液を表面に滴下したところ、印刷用紙とティッシュペーパでは3時間後まで、木材や布は2日後まで、ガラスや紙幣は4日後まで、ステンレス鋼やプラスチックは7日後まで活性を有していた(初期値の~0.1%)とする報告もあります29)。ただし、これらは実験室内でコントロールされた条件下の試験であり、実環境中では温度・湿度・紫外線の影響をウイルスが受けうることや、ウイルスの活性を調べているがヒトへ感染するかどうかを調べている試験ではない、という点には注意が必要です。実環境における報告では、新型コロナウイルス(SARS-CoV-2)の患者の病室において、ドアノブやベッドレールなどの手の触れるところだけでなく、床や窓や排気ファンなど沈着したと考えられる箇所からもウイルスが検出されています5,12)。室内の床面や各種表面に沈着したウイルスからの接触感染の可能性もあるため、床面やテーブルやドアノブ等の表面について消毒用エタノールや適切に希釈した次亜塩素酸ナトリウム液を使用した殺菌処理を定期的に行うことが必要と考えられます。ただし、次亜塩素酸ナトリウムは、皮膚に対する刺激があり、また消毒した表面に腐食や変色を起こす可能性があります。
室内の床面上のダストは、歩行やドアの開閉や掃除などの人の活動によって再飛散(巻き上げられること)が起こります30)。ダストのサイズ・性状や床面の材質や環境条件によって、再飛散率は大きく異なりますが、金属粒子などのダストの再飛散率は0.000001%–0.1%、カビやバクテリアなどの再飛散率は0.0001%–0.1%とされています30)。再飛散率が高くないためか、ウイルス(バクテリオファージ T4)を用いた試験では、ウイルスが検出された床上を歩いた時に、気中からウイルスは検出されませんでした27)。

【さいごに】
感染者が呼吸・会話・咳・くしゃみなどをすると、ウイルスを含む飛沫が環境中に飛散します。会話や咳で飛散する大きな粒子は、多くの場合2 m以内に床面に沈着しますが、室内の気流によっては5 m程度飛散することもあります。また、飛沫核などの小さな粒子は、沈着せずに数時間もしくはそれ以上室内を漂う可能性もあります。室内空気中からウイルスが除去される経路としては、床面や壁面への沈着、換気による屋外への排出、ウイルスの不活化があります。10 μmを超えるサイズの粒子ではほぼ沈着で除去されますが、数μm以下の粒子では換気と不活化の寄与が大きいと考えられます。室内を漂うエアロゾル上の新型コロナウイルスの不活化の半減期は1.1時間程度という報告があることから、換気をしなければ1時間後でも半分のウイルスは活性を持っている可能性があると考えられます。さらに、日本の一般家屋の日常生活時の換気回数は、春夏で1.2–1.7回/h、秋冬で0.6回/h程度であり、病室などで感染対策として取られる換気回数よりはるかに低いため、室内濃度をより効率的に低減させるためには窓開け換気が推奨されます。ただし、屋外の風向や風速によっては、窓開け換気でも十分な換気量が得られないケースもあると思われます。空気清浄機については、コロナウイルスについての研究はありませんが、ウイルスについては一定の効果が認められているため、有用であると思われますが、換気との併用が望ましいでしょう。マスクについては、感染者からの感染リスク低減に効果があると思われるため、着用が望ましいと考えられますが、それらの研究の整理については、別の機会に譲りたいと思います。また、本稿では対象としませんでしたが、接触感染の防止のために、うがいや手洗いを徹底することが、感染防止の観点からも非常に大事だと考えられます。
※ WHOにおける用語の定義1)
- 接触感染
(contact transmission) 直接接触(direct contact)と間接接触 (indirect contact)による感染(transmission)
- 飛沫感染
(droplet transmission) 主に<1 mの距離で生じる飛沫(droplet)による感染
- 空気感染
(airborne transmission) 飛沫核(droplet nuclei)の飛散・吸入による感染
- 飛沫
(droplet) 5 μmより大きい吸入性エアロゾル
- 飛沫核
(droplet nuclei) 5 μmより小さい吸入性エアロゾルで飛沫が乾燥した吸入性エアロゾル残渣(residue of dried respiratory aerosols)
- 感染性吸入性エアロゾル
(infectious respiratory aerosols) 吸入可能なサイズの感染性の飛沫と飛沫核
【謝辞】本稿は、公開に先駆けて、室内環境学会学術委員会によりコメントをいただき、修正いたしました。学術委員会の川上裕司先生(株式会社エフシージー総合研究所)、清水一男先生(静岡大学)、池田四郎先生(株式会社ガステック)、野﨑淳夫先生(東北文化学園大学大学院)、中島大介先生(国立研究開発法人国立環境研究所)、北條祥子先生(東北大学大学院歯学研究科)、水越厚史先生(近畿大学医学部)、徳村雅弘先生(静岡県立大学)、高木麻衣先生(国立研究開発法人国立環境研究所)、理事会の関根嘉香先生(東海大学)、山口一先生(大同大学)、鍵直樹先生(東京工業大学)、三宅祐一先生(静岡県立大学)に深く感謝申し上げます。
【引用文献】
- World Health Organization: Infection prevention and control of epidemic- and pandemic-prone acute respiratory infections in health care. Geneva: World Health Organization (2014) https://apps.who.int/iris/bitstream/handle/10665/112656/9789241507134_eng.pdf?sequence=1
- Chan J et al.: A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet, 395: 514–523. (2020)
- Li Q et al.: Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia. The New England Journal of Medicine, 382: 1199–1207. (2020)
- Huang C et al. : Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, 395: 497–506. (2020)
- Ong SWX et al.: Air, Surface Environmental, and Personal Protective Equipment Contamination by Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) From a Symptomatic Patient. JAMA, E1–E3 (2020)
- World Health Organization: Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19) 16-24 February 2020. (2020) https://www.who.int/docs/default-source/coronaviruse/who-china-joint-mission-on-covid-19-final-report.pdf
- Bella J et al.: Review: Rhinoviruses and their ICAM receptors. Journal of Structural Biology, 128: 69–74. (1999)
- Noda T: Native morphology of influenza virions. Frontiers in Microbiology, 3: 269. (2012)
- Chen N et al.: Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet, 395: 507-513. (2020)
- Johnson GR et al.: Modality of human expired aerosol size distributions. Journal of Aerosol Science. 42: 839-851. (2011)
- Lindsley WG et al.: Quantity and Size Distribution of Cough-Generated Aerosol Particles Produced by Influenza Patients During and After Illness. Journal of Occupational and Environmental Hygiene, 9: 443–449. (2012)
- Chia PY et al.: Detection of Air and Surface Contamination by Severe Acute Respiratory Syndrome 1 Coronavirus 2 (SARS-CoV-2) in Hospital Rooms of Infected Patients. (Preprint from BioRXiv) (2020) https://doi.org/10.1101/2020.03.29.20046557
- Liu Y et al.: Aerodynamic Characteristics and RNA Concentration of SARS-CoV-2 Aerosol in Wuhan Hospitals during COVID-19 Outbreak. (Preprint from BioRXiv). (2020) https://doi.org/10.1101/2020.03.08.982637
- Xie X et al.: How far droplets can move in indoor environments – revisiting the Wells evaporation–falling curve. Indoor air. 17: 211–225. (2007)
- Chen C and Zhao B: Some questions on dispersion of human exhaled droplets in ventilation room: answers from numerical investigation. Indoor Air, 20: 95-111. (2010)
- Morawska L et al.: Size distribution and sites of origin of droplets expelled from the human respiratory tract during expiratory activities. Journal of Aerosol Science. 40, 256–269. (2009)
- Nicas M et al.: Toward understanding the risk of secondary airborne infection: emission of respirable pathogens, Journal of Occupational and Environmental Hygiene, 2, 143–154. (2005)
- Yang W and Marr LC: Dynamics of Airborne Influenza A Viruses Indoors and Dependence on Humidity. PlosOne, 6: e21481. (2011)
- van Doremalen N et al.: Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England Journal of Medicine (in print) https://www.nejm.org/doi/pdf/10.1056/NEJMc2004973
- Shinohara N et al.: Distribution and variability of the 24-h average air exchange rates and interzonal flow rates in 26 Japanese residences over 5 seasons. Atmospheric Environment, 45: 3548–3552. (2011)
- Hou J et al.: Air change rates at night in northeast Chinese homes. Building and Environment, 132: 273–281. (2018)
- Xiao Y et al.: Effects of source emission and window opening on winter indoor particle concentrations in the severe cold region of China. Building and Environment, 144: 23–33. (2018)
- Wang J et al.: Numerical investigation of single-sided natural ventilation driven by buoyancy and wind through variable window configurations. Energy and Buildings, 168: 147–164. (2018)
- Adhikari U et al.: A Case Study Evaluating the Risk of Infection from Middle Eastern Respiratory Syndrome Coronavirus (MERS-CoV) in a Hospital Setting Through Bioaerosols. Risk Analysis, 39: 2608–2624. (2019)
- Riley WJ et al.: Indoor particulate matter of outdoor origin: Importance of size-dependent removal mechanisms. Environmental Science & Technology, 36: 200–207. (2002)
- Li, S et al.: Effects of relative humidity and particle hygroscopicity on the initial efficiency and aging characteristics of electret HVAC filter media. Building and Environment, 171: 106669. (2020)
- Kunkel SA et al.: Quantifying the size-resolved dynamics of indoor bioaerosol transport and control. Indoor Air, 27: 977–987. (2017)
- Foarde KK et al.: Q Development of a method for measuring single-pass bioaerosol removal efficiencies of a room air cleaner. Aerosol Science and Technology, 30: 223–234. (1999)
- Chin AWH et al.: Stability of SARS-CoV-2 in different environmental conditions. Lancet microbe, (2020) https://doi.org/10.1016/S2666-5247(20)30003-3
- Qian J et al.: Walking-induced particle resuspension in indoor environments. Atmospheric environment, 89: 464–481. (2014)
現在感染が拡大しているコロナウイルスなどのウイルスは、接触を介した感染と吸入性エアロゾルを介した感染により広がるとされています1)。さらに、新型コロナウイルスの感染経路としても、状況から判断して、接触感染とエアロゾルを介した感染が起きていると考えられています2-6)。接触感染は、握手やハグなどで生じる直接接触によるものと、ドアノブや家電や消費者製品などに触れることにより生じる間接接触によるものに分けられます1)。吸入性エアロゾルを介した感染は、咳やくしゃみや発声に伴って排出される飛沫(主に>5 μmの液滴(μm(マイクロメートル)は、1 mm(ミリメートル)の1000分の1の大きさ))によるもの(いわゆる飛沫感染)と、それらの水分が蒸発して残る飛沫核(<5 μmの粒子)によるもの(いわゆる空気感染)に分けられます1)。本稿では、以下に、飛沫及び飛沫核を介した感染対策に有用だと思われる情報を整理しました。
【飛沫の大きさと室内での飛散】
ウイルス自体の大きさは、0.03 μm (リノウイルス7)), 0.08–0.12 μm (インフルエンザウイルス8)), 0.050–0.2 μm (新型コロナウイルス(SARS-CoV-2)9))などとされていますが、それらはさらに大きい飛沫の中に含まれて気中に出てきます。話すときや咳をしたときの呼気中の飛沫の大きさは、0.01 μmから数mm程度であり、個数濃度としては2 μm前後と120–150 μm辺りにピークを持つサイズ分布をしています10)。咳をした時の液滴を0.35 μmから10 μmまで測定したところ、小さい粒子ほど個数が多く、インフルエンザ患者で咳一回当たり75000個/咳、治癒後は咳一回当たり52000個/咳の粒子が含まれていたという報告もあります11)。病院の飛沫中の新型コロナウイルスについては、<1 μmの液滴では検出されず、1–4 μmで>4 μmより高いもしくは同等だったという報告12)、<0.25–>2.5 μmで検出されたものの明らかな粒径分布に関する傾向はなかったという報告13)等がありますが、これらは今のところ査読前原稿であり、また例数も少ないため、今後の知見の集積が待たれるところです。
60 μmを超える大きな飛沫は、通常の呼吸(<1 m/s)では感染者から0.5 m以内、話す場合(<5 m/s)には1 m以内、咳をする場合(<10 m/s)には2 m以内、くしゃみをする場合(20–50 m/s)には3–6 m以内で、重力沈降で床面に沈着して気中からなくなるもしくは水分が蒸発して飛沫核になるとされています14)。これらの研究を元にして、現在多くの国において2 mや6 feet(約1.8 m)のソーシャルディスタンシングを取ることが求められています(2014年のWHOのガイドラインではソーシャルディスタンシングとして最低1 m(3 feet)の距離を取ることを求めています1))。ただし、換気や空調などの室内の気流条件によっては、通常の呼吸をしているだけでも100 μmの飛沫でも感染者から5 m程度まで飛散する可能性もあります15)。
飛沫の水分の蒸発は、0.5–20 μmの粒子では0.8秒16)、50 μmの粒子で2秒、200 μmの粒子でも24秒であり14)、環境中と水分量が平衡となった飛沫核となります。飛沫核は、大部分が糖タンパク質からできており、残りがナトリウム、カリウム、塩素、乳酸塩などからできています17)。また、蒸発後の飛沫核の大きさ(直径)は湿度によって異なるとされており、飛沫を模したNaCl(塩化ナトリウム)の液滴を用いた実験と糖タンパク質を含んでいた場合の推定結果(NaCl液滴と糖タンパクを含む液滴の場合の違いは4%程度しかない)から、相対湿度50%以下では元の飛沫の大きさの40%程度18)、相対湿度90%では元の飛沫の大きさの50%程度になるとされています18)。これらの飛沫核については、一定時間の間、室内空気中を漂うことになります。
2002年に起きたSARSの感染では、飛沫核を介したヒトからヒトの感染も短い距離では生じた可能性はあるものの、主には直接接触もしくは飛沫を介して生じたとされています1)。

【室内空気中での飛沫核の挙動とウイルスの不活化】
室内におけるエアロゾル中のウイルスは、換気・沈着・不活化によって、感染に寄与しなくなります18)。沈着というのは、重力沈降や気流による慣性や拡散などによって、室内の表面に付着して空気中から除かれることを指しています。相対湿度50%の条件下で咳をした10分後には、1 μm、10 μm、>25 μmのエアロゾル中のインフルエンザウイルスは、重力沈降によって0.7%、51.2%、98.8%減少し、換気によって換気回数1回/h及び10回/hの場合(換気回数の意味については次の項を参照)でサイズに拠らず15%及び81%減少し、不活化によってサイズに拠らず15%減少するという報告があります(それぞれ独立に計算しているため合計は100%を超えていることに注意)18)。つまり、大きい粒子は沈着により空気中から除かれますが、小さい粒子では換気により屋外に排出されるか不活化されるのを待つことになります。エアロゾル中のインフルエンザウイルスは、湿度が高いほど不活化しやすく、また沈着しやすいとされています。相対湿度10%の場合と比べて相対湿度90%の場合では、10分、30分、1時間後に、失活速度は1.4倍、2.7倍、7.3倍に、沈着速度は1.7倍、2.0倍、2.2倍になったという報告もあります18)。実験室(温度22–23°C、相対湿度40%)で発生させたエアロゾル中の新型コロナウイルス(SARS-CoV-2)の生存半減期の中央値は1.1時間(95%信頼区間は0.6–2.6時間)とされています19)。新型コロナウイルスの湿度依存性はよくわかっていませんが、インフルエンザウイルスと比べて、不活化するのにより多くの時間を要する可能性があります。
【室内の換気】
日本の住宅は、建築基準法で新築時に0.5回/h以上の機械換気設備の設置が義務付けられています。換気回数とは、1時間あたり部屋の空気のどのくらいが外気と交換されるかを示すもので、0.5回/hは、1時間で室内の空気の半分が外気と入れ替わることを意味しています。日常生活を送っている一般住宅における換気回数は、春、夏、秋、冬で1.2、1.7、0.6、0.6回/hという報告があり、春や夏で換気回数が高くなっているのは窓開け時間が長いためだとされています20)。海外(中国)の調査でも、窓開け換気をしている住宅としていない住宅では、3.5回/hと0.8回/h(夏季)及び2.5回/hと0.5回/h(年間)と、換気回数に大きな違いがみられています21)。室内で一度のPM2.5発生があった場合には、10分以内の窓開け換気で室内のPM2.5濃度は外気レベル以下に落ちるとされています22)。窓を開けている場合でも、外気の風速と風向や窓の形状によって換気回数は0.5回/hから数10回/hと大きく変わりうることがモデル計算によって報告されており23)、窓開けをしても換気量が大きく上昇しないこともありえます。
MERS患者の病室における感染リスクを評価した研究では、看護師や医療従事者や家族など近くで患者と接する人の感染リスクは、換気回数が6回/hから12回/hに増えても数%しか減らない一方で、同室の離れた場所にいる他の患者のリスクは半分近くまで減少すると推定されています24)。
一般住宅で日常生活を送っている時の換気回数では、数μm以下の粒子に対しては、数十分~数時間曝露され続けることとなります。このことから、定常的もしくは断続的に発生が想定される場合には、常時窓開けをしておくことが望ましいです。ただし、季節や部屋の目的によっては常時の窓開けが困難なケースも考えられます。そのような場合には、一定時間ごとの窓開け換気をすることとなりますが、曝露を減らす対策としては不十分な可能性もあります。
換気によって屋外に排出された空気中にウイルスが含まれている場合も、多くの場合は外気によって非常に高倍率で希釈されるため、屋外での感染には寄与しないと考えられます。ただし、排気口のすぐそばに喫煙所などの人が集まる場所がある場合や、排気口のすぐそばに吸気口がある場合などには、注意が必要なケースもあるかもしれません。
【室内空気の清浄化】
フィルターによる粒径別粒子の捕集効率は、0.1 μm前後で非常に低く、数 μm以上や0.01 μm以下では非常に高いとされています25)。ただし、粒子捕集効率はフィルターによって大きく異なっており、40% ASHRAEフィルター、85% ASHRAEフィルター、標準ファーネスフィルターの粒子捕集効率は、10 nm以下の粒子では、それぞれ40%–100%、40%–100%、100%、数10 nm–数100 nmの粒子で10%以下、20%以下、40%–80%、数 μm以上の粒子では80%–100%、100%、100%だったという報告もあります25)。(ASHRAEは、アメリカ暖房冷凍空調学会のことで、空調システムや換気などに関する各種規格の策定もしている組織です。40%と85%は、研究された当時のASHRAEの規格での粒子の捕集効率と思われます)。静電フィルターでは、これらのサブミクロン領域の低捕集効率が改善され、0.03–0.6 μmの粒子の捕集効率は、市販のHEPAフィルターでそれ以上ではほぼ100%(0.03 μmのみ97%程度、放電状態では40%–90%)、作成したCMフィルターで85%以上(放電状態では30%–80%)、市販のMERV13フィルターで60%以上(放電状態では数%–25%)と向上したとされています26)(HEPAフィルターは、JIS(日本工業規格)で粒径0.3 µmの粒子の捕集効率が99.97%以上とされるフィルターです。CMフィルターはこの研究において作成された市販でない複合素材でのフィルターです。MERVは、米国のフィルターの規格(ASHRAE 52.2 (2007))でMERV 1からMERV 16まであり、MERVE13は0.3–1 μmの粒子の捕集効率が75%以下とされているものです。ちなみに、MERVE16は、0.3–1 μmの粒子の捕集効率が95%以上とされています)。市販の空気清浄機は、数m3/分から10 m3/分のため、HEPAフィルターが搭載されているものであれば、12畳の部屋で3–15回/h程度の換気に相当する可能性があります。HVACシステムでフィルターを通して空気清浄化を行った場合(循環回数0.8–0.9回/h)、咳を模した装置から発生するウイルス(バクテリオファージ T4)の気中濃度は、0.5 m離れた位置では3種類のどのフィルターでも20%程度しか減少せず、3 m離れた位置では20%–80%、5 m離れた位置では70%–98%、12%–92%とフィルターごとに大きく異なる効率で減少します27)(HVACシステムは、暖房・換気・エアコンの機能を一体化したシステム)。HEPAフィルターを搭載した大型の空気清浄化システムを使用した場合(51回/h)、ウイルス(バクテリオファージ MS2)を含むエアロゾル発生器から発生させたウイルスはバクテリアやカビよりは除去効率が低いものの、95%が除去されたとする報告もあります28)。ただし、HEPAフィルターも製品によって性能に違いがあることやウイルスの種類によって効果が小さい場合もありうることには注意が必要です。これらのことから、空気清浄機を使用する場合にも、換気との併用が望ましいと思われます。また、フィルターの取り換え時の曝露が懸念されるため、フィルターの交換は手袋やマスクをした上で、屋外において行うことが望ましいでしょう。
【室内における沈着と再飛散】
大きな粒子では重力沈降により床面に沈着したり移流により壁面に沈着したりすることが多く、小さな粒子では拡散により床面だけでなく天井や壁面や家具などの表面に沈着することが多いとされています。100 μm, 10 μm, 0.1 μmの粒子の床面に沈着する割合は43%–79%、0.6%–18%、2.5%–18%と仮定でき、壁面に沈着する割合は8.7%–47%、51%–86%、51%–89%と仮定できるとしている研究もあります15)。
大きい飛沫は重力沈降により数秒から15秒程度で床面に沈着しますが、小さい粒子はより長時間空気中を漂っています14)。ウイルス(バクテリオファージ T4)の床面への沈着は、大きな大腸菌のケースと違い、咳をした近く(0.5 m)では少なく、3 m離れた位置で高く、5 m離れた地点でも0.5 mの地点より高かったという報告があり27)、感染者から少し離れた場所で床面に沈着する量が多いと思われます。ちなみに、温度21–23°C相対湿度40%の実験室で行った実験では、銅、段ボール紙、ステンレス鋼、プラスチックの表面における新型コロナウイルス(SARS-CoV-2)の不活化の半減期の中央値は、0.77時間、3.5時間、5.6時間、6.8時間とされており、最大では48時間後のステンレス鋼表面(初期値の0.8%)や72時間後のプラスチック表面(初期値の2%)でもウイルスの活性が確認されたとされており19)、沈着後もしばらくは活性を維持していると考えられます。他にも、温度22°C相対湿度65%の実験室において、新型コロナウイルス(SARS-CoV-2)を含む液を表面に滴下したところ、印刷用紙とティッシュペーパでは3時間後まで、木材や布は2日後まで、ガラスや紙幣は4日後まで、ステンレス鋼やプラスチックは7日後まで活性を有していた(初期値の~0.1%)とする報告もあります29)。ただし、これらは実験室内でコントロールされた条件下の試験であり、実環境中では温度・湿度・紫外線の影響をウイルスが受けうることや、ウイルスの活性を調べているがヒトへ感染するかどうかを調べている試験ではない、という点には注意が必要です。実環境における報告では、新型コロナウイルス(SARS-CoV-2)の患者の病室において、ドアノブやベッドレールなどの手の触れるところだけでなく、床や窓や排気ファンなど沈着したと考えられる箇所からもウイルスが検出されています5,12)。室内の床面や各種表面に沈着したウイルスからの接触感染の可能性もあるため、床面やテーブルやドアノブ等の表面について消毒用エタノールや適切に希釈した次亜塩素酸ナトリウム液を使用した殺菌処理を定期的に行うことが必要と考えられます。ただし、次亜塩素酸ナトリウムは、皮膚に対する刺激があり、また消毒した表面に腐食や変色を起こす可能性があります。
室内の床面上のダストは、歩行やドアの開閉や掃除などの人の活動によって再飛散(巻き上げられること)が起こります30)。ダストのサイズ・性状や床面の材質や環境条件によって、再飛散率は大きく異なりますが、金属粒子などのダストの再飛散率は0.000001%–0.1%、カビやバクテリアなどの再飛散率は0.0001%–0.1%とされています30)。再飛散率が高くないためか、ウイルス(バクテリオファージ T4)を用いた試験では、ウイルスが検出された床上を歩いた時に、気中からウイルスは検出されませんでした27)。

【さいごに】
感染者が呼吸・会話・咳・くしゃみなどをすると、ウイルスを含む飛沫が環境中に飛散します。会話や咳で飛散する大きな粒子は、多くの場合2 m以内に床面に沈着しますが、室内の気流によっては5 m程度飛散することもあります。また、飛沫核などの小さな粒子は、沈着せずに数時間もしくはそれ以上室内を漂う可能性もあります。室内空気中からウイルスが除去される経路としては、床面や壁面への沈着、換気による屋外への排出、ウイルスの不活化があります。10 μmを超えるサイズの粒子ではほぼ沈着で除去されますが、数μm以下の粒子では換気と不活化の寄与が大きいと考えられます。室内を漂うエアロゾル上の新型コロナウイルスの不活化の半減期は1.1時間程度という報告があることから、換気をしなければ1時間後でも半分のウイルスは活性を持っている可能性があると考えられます。さらに、日本の一般家屋の日常生活時の換気回数は、春夏で1.2–1.7回/h、秋冬で0.6回/h程度であり、病室などで感染対策として取られる換気回数よりはるかに低いため、室内濃度をより効率的に低減させるためには窓開け換気が推奨されます。ただし、屋外の風向や風速によっては、窓開け換気でも十分な換気量が得られないケースもあると思われます。空気清浄機については、コロナウイルスについての研究はありませんが、ウイルスについては一定の効果が認められているため、有用であると思われますが、換気との併用が望ましいでしょう。マスクについては、感染者からの感染リスク低減に効果があると思われるため、着用が望ましいと考えられますが、それらの研究の整理については、別の機会に譲りたいと思います。また、本稿では対象としませんでしたが、接触感染の防止のために、うがいや手洗いを徹底することが、感染防止の観点からも非常に大事だと考えられます。
※ WHOにおける用語の定義1)
- 接触感染
(contact transmission) 直接接触(direct contact)と間接接触 (indirect contact)による感染(transmission)
- 飛沫感染
(droplet transmission) 主に<1 mの距離で生じる飛沫(droplet)による感染
- 空気感染
(airborne transmission) 飛沫核(droplet nuclei)の飛散・吸入による感染
- 飛沫
(droplet) 5 μmより大きい吸入性エアロゾル
- 飛沫核
(droplet nuclei) 5 μmより小さい吸入性エアロゾルで飛沫が乾燥した吸入性エアロゾル残渣(residue of dried respiratory aerosols)
- 感染性吸入性エアロゾル
(infectious respiratory aerosols) 吸入可能なサイズの感染性の飛沫と飛沫核
【謝辞】本稿は、公開に先駆けて、室内環境学会学術委員会によりコメントをいただき、修正いたしました。学術委員会の川上裕司先生(株式会社エフシージー総合研究所)、清水一男先生(静岡大学)、池田四郎先生(株式会社ガステック)、野﨑淳夫先生(東北文化学園大学大学院)、中島大介先生(国立研究開発法人国立環境研究所)、北條祥子先生(東北大学大学院歯学研究科)、水越厚史先生(近畿大学医学部)、徳村雅弘先生(静岡県立大学)、高木麻衣先生(国立研究開発法人国立環境研究所)、理事会の関根嘉香先生(東海大学)、山口一先生(大同大学)、鍵直樹先生(東京工業大学)、三宅祐一先生(静岡県立大学)に深く感謝申し上げます。
【引用文献】
- World Health Organization: Infection prevention and control of epidemic- and pandemic-prone acute respiratory infections in health care. Geneva: World Health Organization (2014) https://apps.who.int/iris/bitstream/handle/10665/112656/9789241507134_eng.pdf?sequence=1
- Chan J et al.: A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet, 395: 514–523. (2020)
- Li Q et al.: Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia. The New England Journal of Medicine, 382: 1199–1207. (2020)
- Huang C et al. : Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, 395: 497–506. (2020)
- Ong SWX et al.: Air, Surface Environmental, and Personal Protective Equipment Contamination by Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) From a Symptomatic Patient. JAMA, E1–E3 (2020)
- World Health Organization: Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19) 16-24 February 2020. (2020) https://www.who.int/docs/default-source/coronaviruse/who-china-joint-mission-on-covid-19-final-report.pdf
- Bella J et al.: Review: Rhinoviruses and their ICAM receptors. Journal of Structural Biology, 128: 69–74. (1999)
- Noda T: Native morphology of influenza virions. Frontiers in Microbiology, 3: 269. (2012)
- Chen N et al.: Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet, 395: 507-513. (2020)
- Johnson GR et al.: Modality of human expired aerosol size distributions. Journal of Aerosol Science. 42: 839-851. (2011)
- Lindsley WG et al.: Quantity and Size Distribution of Cough-Generated Aerosol Particles Produced by Influenza Patients During and After Illness. Journal of Occupational and Environmental Hygiene, 9: 443–449. (2012)
- Chia PY et al.: Detection of Air and Surface Contamination by Severe Acute Respiratory Syndrome 1 Coronavirus 2 (SARS-CoV-2) in Hospital Rooms of Infected Patients. (Preprint from BioRXiv) (2020) https://doi.org/10.1101/2020.03.29.20046557
- Liu Y et al.: Aerodynamic Characteristics and RNA Concentration of SARS-CoV-2 Aerosol in Wuhan Hospitals during COVID-19 Outbreak. (Preprint from BioRXiv). (2020) https://doi.org/10.1101/2020.03.08.982637
- Xie X et al.: How far droplets can move in indoor environments – revisiting the Wells evaporation–falling curve. Indoor air. 17: 211–225. (2007)
- Chen C and Zhao B: Some questions on dispersion of human exhaled droplets in ventilation room: answers from numerical investigation. Indoor Air, 20: 95-111. (2010)
- Morawska L et al.: Size distribution and sites of origin of droplets expelled from the human respiratory tract during expiratory activities. Journal of Aerosol Science. 40, 256–269. (2009)
- Nicas M et al.: Toward understanding the risk of secondary airborne infection: emission of respirable pathogens, Journal of Occupational and Environmental Hygiene, 2, 143–154. (2005)
- Yang W and Marr LC: Dynamics of Airborne Influenza A Viruses Indoors and Dependence on Humidity. PlosOne, 6: e21481. (2011)
- van Doremalen N et al.: Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England Journal of Medicine (in print) https://www.nejm.org/doi/pdf/10.1056/NEJMc2004973
- Shinohara N et al.: Distribution and variability of the 24-h average air exchange rates and interzonal flow rates in 26 Japanese residences over 5 seasons. Atmospheric Environment, 45: 3548–3552. (2011)
- Hou J et al.: Air change rates at night in northeast Chinese homes. Building and Environment, 132: 273–281. (2018)
- Xiao Y et al.: Effects of source emission and window opening on winter indoor particle concentrations in the severe cold region of China. Building and Environment, 144: 23–33. (2018)
- Wang J et al.: Numerical investigation of single-sided natural ventilation driven by buoyancy and wind through variable window configurations. Energy and Buildings, 168: 147–164. (2018)
- Adhikari U et al.: A Case Study Evaluating the Risk of Infection from Middle Eastern Respiratory Syndrome Coronavirus (MERS-CoV) in a Hospital Setting Through Bioaerosols. Risk Analysis, 39: 2608–2624. (2019)
- Riley WJ et al.: Indoor particulate matter of outdoor origin: Importance of size-dependent removal mechanisms. Environmental Science & Technology, 36: 200–207. (2002)
- Li, S et al.: Effects of relative humidity and particle hygroscopicity on the initial efficiency and aging characteristics of electret HVAC filter media. Building and Environment, 171: 106669. (2020)
- Kunkel SA et al.: Quantifying the size-resolved dynamics of indoor bioaerosol transport and control. Indoor Air, 27: 977–987. (2017)
- Foarde KK et al.: Q Development of a method for measuring single-pass bioaerosol removal efficiencies of a room air cleaner. Aerosol Science and Technology, 30: 223–234. (1999)
- Chin AWH et al.: Stability of SARS-CoV-2 in different environmental conditions. Lancet microbe, (2020) https://doi.org/10.1016/S2666-5247(20)30003-3
- Qian J et al.: Walking-induced particle resuspension in indoor environments. Atmospheric environment, 89: 464–481. (2014)
ウイルス自体の大きさは、0.03 μm (リノウイルス7)), 0.08–0.12 μm (インフルエンザウイルス8)), 0.050–0.2 μm (新型コロナウイルス(SARS-CoV-2)9))などとされていますが、それらはさらに大きい飛沫の中に含まれて気中に出てきます。話すときや咳をしたときの呼気中の飛沫の大きさは、0.01 μmから数mm程度であり、個数濃度としては2 μm前後と120–150 μm辺りにピークを持つサイズ分布をしています10)。咳をした時の液滴を0.35 μmから10 μmまで測定したところ、小さい粒子ほど個数が多く、インフルエンザ患者で咳一回当たり75000個/咳、治癒後は咳一回当たり52000個/咳の粒子が含まれていたという報告もあります11)。病院の飛沫中の新型コロナウイルスについては、<1 μmの液滴では検出されず、1–4 μmで>4 μmより高いもしくは同等だったという報告12)、<0.25–>2.5 μmで検出されたものの明らかな粒径分布に関する傾向はなかったという報告13)等がありますが、これらは今のところ査読前原稿であり、また例数も少ないため、今後の知見の集積が待たれるところです。
60 μmを超える大きな飛沫は、通常の呼吸(<1 m/s)では感染者から0.5 m以内、話す場合(<5 m/s)には1 m以内、咳をする場合(<10 m/s)には2 m以内、くしゃみをする場合(20–50 m/s)には3–6 m以内で、重力沈降で床面に沈着して気中からなくなるもしくは水分が蒸発して飛沫核になるとされています14)。これらの研究を元にして、現在多くの国において2 mや6 feet(約1.8 m)のソーシャルディスタンシングを取ることが求められています(2014年のWHOのガイドラインではソーシャルディスタンシングとして最低1 m(3 feet)の距離を取ることを求めています1))。ただし、換気や空調などの室内の気流条件によっては、通常の呼吸をしているだけでも100 μmの飛沫でも感染者から5 m程度まで飛散する可能性もあります15)。
飛沫の水分の蒸発は、0.5–20 μmの粒子では0.8秒16)、50 μmの粒子で2秒、200 μmの粒子でも24秒であり14)、環境中と水分量が平衡となった飛沫核となります。飛沫核は、大部分が糖タンパク質からできており、残りがナトリウム、カリウム、塩素、乳酸塩などからできています17)。また、蒸発後の飛沫核の大きさ(直径)は湿度によって異なるとされており、飛沫を模したNaCl(塩化ナトリウム)の液滴を用いた実験と糖タンパク質を含んでいた場合の推定結果(NaCl液滴と糖タンパクを含む液滴の場合の違いは4%程度しかない)から、相対湿度50%以下では元の飛沫の大きさの40%程度18)、相対湿度90%では元の飛沫の大きさの50%程度になるとされています18)。これらの飛沫核については、一定時間の間、室内空気中を漂うことになります。
2002年に起きたSARSの感染では、飛沫核を介したヒトからヒトの感染も短い距離では生じた可能性はあるものの、主には直接接触もしくは飛沫を介して生じたとされています1)。

60 μmを超える大きな飛沫は、通常の呼吸(<1 m/s)では感染者から0.5 m以内、話す場合(<5 m/s)には1 m以内、咳をする場合(<10 m/s)には2 m以内、くしゃみをする場合(20–50 m/s)には3–6 m以内で、重力沈降で床面に沈着して気中からなくなるもしくは水分が蒸発して飛沫核になるとされています14)。これらの研究を元にして、現在多くの国において2 mや6 feet(約1.8 m)のソーシャルディスタンシングを取ることが求められています(2014年のWHOのガイドラインではソーシャルディスタンシングとして最低1 m(3 feet)の距離を取ることを求めています1))。ただし、換気や空調などの室内の気流条件によっては、通常の呼吸をしているだけでも100 μmの飛沫でも感染者から5 m程度まで飛散する可能性もあります15)。
飛沫の水分の蒸発は、0.5–20 μmの粒子では0.8秒16)、50 μmの粒子で2秒、200 μmの粒子でも24秒であり14)、環境中と水分量が平衡となった飛沫核となります。飛沫核は、大部分が糖タンパク質からできており、残りがナトリウム、カリウム、塩素、乳酸塩などからできています17)。また、蒸発後の飛沫核の大きさ(直径)は湿度によって異なるとされており、飛沫を模したNaCl(塩化ナトリウム)の液滴を用いた実験と糖タンパク質を含んでいた場合の推定結果(NaCl液滴と糖タンパクを含む液滴の場合の違いは4%程度しかない)から、相対湿度50%以下では元の飛沫の大きさの40%程度18)、相対湿度90%では元の飛沫の大きさの50%程度になるとされています18)。これらの飛沫核については、一定時間の間、室内空気中を漂うことになります。
2002年に起きたSARSの感染では、飛沫核を介したヒトからヒトの感染も短い距離では生じた可能性はあるものの、主には直接接触もしくは飛沫を介して生じたとされています1)。

【室内空気中での飛沫核の挙動とウイルスの不活化】
室内におけるエアロゾル中のウイルスは、換気・沈着・不活化によって、感染に寄与しなくなります18)。沈着というのは、重力沈降や気流による慣性や拡散などによって、室内の表面に付着して空気中から除かれることを指しています。相対湿度50%の条件下で咳をした10分後には、1 μm、10 μm、>25 μmのエアロゾル中のインフルエンザウイルスは、重力沈降によって0.7%、51.2%、98.8%減少し、換気によって換気回数1回/h及び10回/hの場合(換気回数の意味については次の項を参照)でサイズに拠らず15%及び81%減少し、不活化によってサイズに拠らず15%減少するという報告があります(それぞれ独立に計算しているため合計は100%を超えていることに注意)18)。つまり、大きい粒子は沈着により空気中から除かれますが、小さい粒子では換気により屋外に排出されるか不活化されるのを待つことになります。エアロゾル中のインフルエンザウイルスは、湿度が高いほど不活化しやすく、また沈着しやすいとされています。相対湿度10%の場合と比べて相対湿度90%の場合では、10分、30分、1時間後に、失活速度は1.4倍、2.7倍、7.3倍に、沈着速度は1.7倍、2.0倍、2.2倍になったという報告もあります18)。実験室(温度22–23°C、相対湿度40%)で発生させたエアロゾル中の新型コロナウイルス(SARS-CoV-2)の生存半減期の中央値は1.1時間(95%信頼区間は0.6–2.6時間)とされています19)。新型コロナウイルスの湿度依存性はよくわかっていませんが、インフルエンザウイルスと比べて、不活化するのにより多くの時間を要する可能性があります。
【室内の換気】
日本の住宅は、建築基準法で新築時に0.5回/h以上の機械換気設備の設置が義務付けられています。換気回数とは、1時間あたり部屋の空気のどのくらいが外気と交換されるかを示すもので、0.5回/hは、1時間で室内の空気の半分が外気と入れ替わることを意味しています。日常生活を送っている一般住宅における換気回数は、春、夏、秋、冬で1.2、1.7、0.6、0.6回/hという報告があり、春や夏で換気回数が高くなっているのは窓開け時間が長いためだとされています20)。海外(中国)の調査でも、窓開け換気をしている住宅としていない住宅では、3.5回/hと0.8回/h(夏季)及び2.5回/hと0.5回/h(年間)と、換気回数に大きな違いがみられています21)。室内で一度のPM2.5発生があった場合には、10分以内の窓開け換気で室内のPM2.5濃度は外気レベル以下に落ちるとされています22)。窓を開けている場合でも、外気の風速と風向や窓の形状によって換気回数は0.5回/hから数10回/hと大きく変わりうることがモデル計算によって報告されており23)、窓開けをしても換気量が大きく上昇しないこともありえます。
MERS患者の病室における感染リスクを評価した研究では、看護師や医療従事者や家族など近くで患者と接する人の感染リスクは、換気回数が6回/hから12回/hに増えても数%しか減らない一方で、同室の離れた場所にいる他の患者のリスクは半分近くまで減少すると推定されています24)。
一般住宅で日常生活を送っている時の換気回数では、数μm以下の粒子に対しては、数十分~数時間曝露され続けることとなります。このことから、定常的もしくは断続的に発生が想定される場合には、常時窓開けをしておくことが望ましいです。ただし、季節や部屋の目的によっては常時の窓開けが困難なケースも考えられます。そのような場合には、一定時間ごとの窓開け換気をすることとなりますが、曝露を減らす対策としては不十分な可能性もあります。
換気によって屋外に排出された空気中にウイルスが含まれている場合も、多くの場合は外気によって非常に高倍率で希釈されるため、屋外での感染には寄与しないと考えられます。ただし、排気口のすぐそばに喫煙所などの人が集まる場所がある場合や、排気口のすぐそばに吸気口がある場合などには、注意が必要なケースもあるかもしれません。
【室内空気の清浄化】
フィルターによる粒径別粒子の捕集効率は、0.1 μm前後で非常に低く、数 μm以上や0.01 μm以下では非常に高いとされています25)。ただし、粒子捕集効率はフィルターによって大きく異なっており、40% ASHRAEフィルター、85% ASHRAEフィルター、標準ファーネスフィルターの粒子捕集効率は、10 nm以下の粒子では、それぞれ40%–100%、40%–100%、100%、数10 nm–数100 nmの粒子で10%以下、20%以下、40%–80%、数 μm以上の粒子では80%–100%、100%、100%だったという報告もあります25)。(ASHRAEは、アメリカ暖房冷凍空調学会のことで、空調システムや換気などに関する各種規格の策定もしている組織です。40%と85%は、研究された当時のASHRAEの規格での粒子の捕集効率と思われます)。静電フィルターでは、これらのサブミクロン領域の低捕集効率が改善され、0.03–0.6 μmの粒子の捕集効率は、市販のHEPAフィルターでそれ以上ではほぼ100%(0.03 μmのみ97%程度、放電状態では40%–90%)、作成したCMフィルターで85%以上(放電状態では30%–80%)、市販のMERV13フィルターで60%以上(放電状態では数%–25%)と向上したとされています26)(HEPAフィルターは、JIS(日本工業規格)で粒径0.3 µmの粒子の捕集効率が99.97%以上とされるフィルターです。CMフィルターはこの研究において作成された市販でない複合素材でのフィルターです。MERVは、米国のフィルターの規格(ASHRAE 52.2 (2007))でMERV 1からMERV 16まであり、MERVE13は0.3–1 μmの粒子の捕集効率が75%以下とされているものです。ちなみに、MERVE16は、0.3–1 μmの粒子の捕集効率が95%以上とされています)。市販の空気清浄機は、数m3/分から10 m3/分のため、HEPAフィルターが搭載されているものであれば、12畳の部屋で3–15回/h程度の換気に相当する可能性があります。HVACシステムでフィルターを通して空気清浄化を行った場合(循環回数0.8–0.9回/h)、咳を模した装置から発生するウイルス(バクテリオファージ T4)の気中濃度は、0.5 m離れた位置では3種類のどのフィルターでも20%程度しか減少せず、3 m離れた位置では20%–80%、5 m離れた位置では70%–98%、12%–92%とフィルターごとに大きく異なる効率で減少します27)(HVACシステムは、暖房・換気・エアコンの機能を一体化したシステム)。HEPAフィルターを搭載した大型の空気清浄化システムを使用した場合(51回/h)、ウイルス(バクテリオファージ MS2)を含むエアロゾル発生器から発生させたウイルスはバクテリアやカビよりは除去効率が低いものの、95%が除去されたとする報告もあります28)。ただし、HEPAフィルターも製品によって性能に違いがあることやウイルスの種類によって効果が小さい場合もありうることには注意が必要です。これらのことから、空気清浄機を使用する場合にも、換気との併用が望ましいと思われます。また、フィルターの取り換え時の曝露が懸念されるため、フィルターの交換は手袋やマスクをした上で、屋外において行うことが望ましいでしょう。
【室内における沈着と再飛散】
大きな粒子では重力沈降により床面に沈着したり移流により壁面に沈着したりすることが多く、小さな粒子では拡散により床面だけでなく天井や壁面や家具などの表面に沈着することが多いとされています。100 μm, 10 μm, 0.1 μmの粒子の床面に沈着する割合は43%–79%、0.6%–18%、2.5%–18%と仮定でき、壁面に沈着する割合は8.7%–47%、51%–86%、51%–89%と仮定できるとしている研究もあります15)。
大きい飛沫は重力沈降により数秒から15秒程度で床面に沈着しますが、小さい粒子はより長時間空気中を漂っています14)。ウイルス(バクテリオファージ T4)の床面への沈着は、大きな大腸菌のケースと違い、咳をした近く(0.5 m)では少なく、3 m離れた位置で高く、5 m離れた地点でも0.5 mの地点より高かったという報告があり27)、感染者から少し離れた場所で床面に沈着する量が多いと思われます。ちなみに、温度21–23°C相対湿度40%の実験室で行った実験では、銅、段ボール紙、ステンレス鋼、プラスチックの表面における新型コロナウイルス(SARS-CoV-2)の不活化の半減期の中央値は、0.77時間、3.5時間、5.6時間、6.8時間とされており、最大では48時間後のステンレス鋼表面(初期値の0.8%)や72時間後のプラスチック表面(初期値の2%)でもウイルスの活性が確認されたとされており19)、沈着後もしばらくは活性を維持していると考えられます。他にも、温度22°C相対湿度65%の実験室において、新型コロナウイルス(SARS-CoV-2)を含む液を表面に滴下したところ、印刷用紙とティッシュペーパでは3時間後まで、木材や布は2日後まで、ガラスや紙幣は4日後まで、ステンレス鋼やプラスチックは7日後まで活性を有していた(初期値の~0.1%)とする報告もあります29)。ただし、これらは実験室内でコントロールされた条件下の試験であり、実環境中では温度・湿度・紫外線の影響をウイルスが受けうることや、ウイルスの活性を調べているがヒトへ感染するかどうかを調べている試験ではない、という点には注意が必要です。実環境における報告では、新型コロナウイルス(SARS-CoV-2)の患者の病室において、ドアノブやベッドレールなどの手の触れるところだけでなく、床や窓や排気ファンなど沈着したと考えられる箇所からもウイルスが検出されています5,12)。室内の床面や各種表面に沈着したウイルスからの接触感染の可能性もあるため、床面やテーブルやドアノブ等の表面について消毒用エタノールや適切に希釈した次亜塩素酸ナトリウム液を使用した殺菌処理を定期的に行うことが必要と考えられます。ただし、次亜塩素酸ナトリウムは、皮膚に対する刺激があり、また消毒した表面に腐食や変色を起こす可能性があります。
室内の床面上のダストは、歩行やドアの開閉や掃除などの人の活動によって再飛散(巻き上げられること)が起こります30)。ダストのサイズ・性状や床面の材質や環境条件によって、再飛散率は大きく異なりますが、金属粒子などのダストの再飛散率は0.000001%–0.1%、カビやバクテリアなどの再飛散率は0.0001%–0.1%とされています30)。再飛散率が高くないためか、ウイルス(バクテリオファージ T4)を用いた試験では、ウイルスが検出された床上を歩いた時に、気中からウイルスは検出されませんでした27)。

【さいごに】
感染者が呼吸・会話・咳・くしゃみなどをすると、ウイルスを含む飛沫が環境中に飛散します。会話や咳で飛散する大きな粒子は、多くの場合2 m以内に床面に沈着しますが、室内の気流によっては5 m程度飛散することもあります。また、飛沫核などの小さな粒子は、沈着せずに数時間もしくはそれ以上室内を漂う可能性もあります。室内空気中からウイルスが除去される経路としては、床面や壁面への沈着、換気による屋外への排出、ウイルスの不活化があります。10 μmを超えるサイズの粒子ではほぼ沈着で除去されますが、数μm以下の粒子では換気と不活化の寄与が大きいと考えられます。室内を漂うエアロゾル上の新型コロナウイルスの不活化の半減期は1.1時間程度という報告があることから、換気をしなければ1時間後でも半分のウイルスは活性を持っている可能性があると考えられます。さらに、日本の一般家屋の日常生活時の換気回数は、春夏で1.2–1.7回/h、秋冬で0.6回/h程度であり、病室などで感染対策として取られる換気回数よりはるかに低いため、室内濃度をより効率的に低減させるためには窓開け換気が推奨されます。ただし、屋外の風向や風速によっては、窓開け換気でも十分な換気量が得られないケースもあると思われます。空気清浄機については、コロナウイルスについての研究はありませんが、ウイルスについては一定の効果が認められているため、有用であると思われますが、換気との併用が望ましいでしょう。マスクについては、感染者からの感染リスク低減に効果があると思われるため、着用が望ましいと考えられますが、それらの研究の整理については、別の機会に譲りたいと思います。また、本稿では対象としませんでしたが、接触感染の防止のために、うがいや手洗いを徹底することが、感染防止の観点からも非常に大事だと考えられます。
※ WHOにおける用語の定義1)
- 接触感染
(contact transmission) 直接接触(direct contact)と間接接触 (indirect contact)による感染(transmission)
- 飛沫感染
(droplet transmission) 主に<1 mの距離で生じる飛沫(droplet)による感染
- 空気感染
(airborne transmission) 飛沫核(droplet nuclei)の飛散・吸入による感染
- 飛沫
(droplet) 5 μmより大きい吸入性エアロゾル
- 飛沫核
(droplet nuclei) 5 μmより小さい吸入性エアロゾルで飛沫が乾燥した吸入性エアロゾル残渣(residue of dried respiratory aerosols)
- 感染性吸入性エアロゾル
(infectious respiratory aerosols) 吸入可能なサイズの感染性の飛沫と飛沫核
【謝辞】本稿は、公開に先駆けて、室内環境学会学術委員会によりコメントをいただき、修正いたしました。学術委員会の川上裕司先生(株式会社エフシージー総合研究所)、清水一男先生(静岡大学)、池田四郎先生(株式会社ガステック)、野﨑淳夫先生(東北文化学園大学大学院)、中島大介先生(国立研究開発法人国立環境研究所)、北條祥子先生(東北大学大学院歯学研究科)、水越厚史先生(近畿大学医学部)、徳村雅弘先生(静岡県立大学)、高木麻衣先生(国立研究開発法人国立環境研究所)、理事会の関根嘉香先生(東海大学)、山口一先生(大同大学)、鍵直樹先生(東京工業大学)、三宅祐一先生(静岡県立大学)に深く感謝申し上げます。
【引用文献】
- World Health Organization: Infection prevention and control of epidemic- and pandemic-prone acute respiratory infections in health care. Geneva: World Health Organization (2014) https://apps.who.int/iris/bitstream/handle/10665/112656/9789241507134_eng.pdf?sequence=1
- Chan J et al.: A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet, 395: 514–523. (2020)
- Li Q et al.: Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia. The New England Journal of Medicine, 382: 1199–1207. (2020)
- Huang C et al. : Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, 395: 497–506. (2020)
- Ong SWX et al.: Air, Surface Environmental, and Personal Protective Equipment Contamination by Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) From a Symptomatic Patient. JAMA, E1–E3 (2020)
- World Health Organization: Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19) 16-24 February 2020. (2020) https://www.who.int/docs/default-source/coronaviruse/who-china-joint-mission-on-covid-19-final-report.pdf
- Bella J et al.: Review: Rhinoviruses and their ICAM receptors. Journal of Structural Biology, 128: 69–74. (1999)
- Noda T: Native morphology of influenza virions. Frontiers in Microbiology, 3: 269. (2012)
- Chen N et al.: Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet, 395: 507-513. (2020)
- Johnson GR et al.: Modality of human expired aerosol size distributions. Journal of Aerosol Science. 42: 839-851. (2011)
- Lindsley WG et al.: Quantity and Size Distribution of Cough-Generated Aerosol Particles Produced by Influenza Patients During and After Illness. Journal of Occupational and Environmental Hygiene, 9: 443–449. (2012)
- Chia PY et al.: Detection of Air and Surface Contamination by Severe Acute Respiratory Syndrome 1 Coronavirus 2 (SARS-CoV-2) in Hospital Rooms of Infected Patients. (Preprint from BioRXiv) (2020) https://doi.org/10.1101/2020.03.29.20046557
- Liu Y et al.: Aerodynamic Characteristics and RNA Concentration of SARS-CoV-2 Aerosol in Wuhan Hospitals during COVID-19 Outbreak. (Preprint from BioRXiv). (2020) https://doi.org/10.1101/2020.03.08.982637
- Xie X et al.: How far droplets can move in indoor environments – revisiting the Wells evaporation–falling curve. Indoor air. 17: 211–225. (2007)
- Chen C and Zhao B: Some questions on dispersion of human exhaled droplets in ventilation room: answers from numerical investigation. Indoor Air, 20: 95-111. (2010)
- Morawska L et al.: Size distribution and sites of origin of droplets expelled from the human respiratory tract during expiratory activities. Journal of Aerosol Science. 40, 256–269. (2009)
- Nicas M et al.: Toward understanding the risk of secondary airborne infection: emission of respirable pathogens, Journal of Occupational and Environmental Hygiene, 2, 143–154. (2005)
- Yang W and Marr LC: Dynamics of Airborne Influenza A Viruses Indoors and Dependence on Humidity. PlosOne, 6: e21481. (2011)
- van Doremalen N et al.: Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England Journal of Medicine (in print) https://www.nejm.org/doi/pdf/10.1056/NEJMc2004973
- Shinohara N et al.: Distribution and variability of the 24-h average air exchange rates and interzonal flow rates in 26 Japanese residences over 5 seasons. Atmospheric Environment, 45: 3548–3552. (2011)
- Hou J et al.: Air change rates at night in northeast Chinese homes. Building and Environment, 132: 273–281. (2018)
- Xiao Y et al.: Effects of source emission and window opening on winter indoor particle concentrations in the severe cold region of China. Building and Environment, 144: 23–33. (2018)
- Wang J et al.: Numerical investigation of single-sided natural ventilation driven by buoyancy and wind through variable window configurations. Energy and Buildings, 168: 147–164. (2018)
- Adhikari U et al.: A Case Study Evaluating the Risk of Infection from Middle Eastern Respiratory Syndrome Coronavirus (MERS-CoV) in a Hospital Setting Through Bioaerosols. Risk Analysis, 39: 2608–2624. (2019)
- Riley WJ et al.: Indoor particulate matter of outdoor origin: Importance of size-dependent removal mechanisms. Environmental Science & Technology, 36: 200–207. (2002)
- Li, S et al.: Effects of relative humidity and particle hygroscopicity on the initial efficiency and aging characteristics of electret HVAC filter media. Building and Environment, 171: 106669. (2020)
- Kunkel SA et al.: Quantifying the size-resolved dynamics of indoor bioaerosol transport and control. Indoor Air, 27: 977–987. (2017)
- Foarde KK et al.: Q Development of a method for measuring single-pass bioaerosol removal efficiencies of a room air cleaner. Aerosol Science and Technology, 30: 223–234. (1999)
- Chin AWH et al.: Stability of SARS-CoV-2 in different environmental conditions. Lancet microbe, (2020) https://doi.org/10.1016/S2666-5247(20)30003-3
- Qian J et al.: Walking-induced particle resuspension in indoor environments. Atmospheric environment, 89: 464–481. (2014)
室内におけるエアロゾル中のウイルスは、換気・沈着・不活化によって、感染に寄与しなくなります18)。沈着というのは、重力沈降や気流による慣性や拡散などによって、室内の表面に付着して空気中から除かれることを指しています。相対湿度50%の条件下で咳をした10分後には、1 μm、10 μm、>25 μmのエアロゾル中のインフルエンザウイルスは、重力沈降によって0.7%、51.2%、98.8%減少し、換気によって換気回数1回/h及び10回/hの場合(換気回数の意味については次の項を参照)でサイズに拠らず15%及び81%減少し、不活化によってサイズに拠らず15%減少するという報告があります(それぞれ独立に計算しているため合計は100%を超えていることに注意)18)。つまり、大きい粒子は沈着により空気中から除かれますが、小さい粒子では換気により屋外に排出されるか不活化されるのを待つことになります。エアロゾル中のインフルエンザウイルスは、湿度が高いほど不活化しやすく、また沈着しやすいとされています。相対湿度10%の場合と比べて相対湿度90%の場合では、10分、30分、1時間後に、失活速度は1.4倍、2.7倍、7.3倍に、沈着速度は1.7倍、2.0倍、2.2倍になったという報告もあります18)。実験室(温度22–23°C、相対湿度40%)で発生させたエアロゾル中の新型コロナウイルス(SARS-CoV-2)の生存半減期の中央値は1.1時間(95%信頼区間は0.6–2.6時間)とされています19)。新型コロナウイルスの湿度依存性はよくわかっていませんが、インフルエンザウイルスと比べて、不活化するのにより多くの時間を要する可能性があります。
【室内の換気】
日本の住宅は、建築基準法で新築時に0.5回/h以上の機械換気設備の設置が義務付けられています。換気回数とは、1時間あたり部屋の空気のどのくらいが外気と交換されるかを示すもので、0.5回/hは、1時間で室内の空気の半分が外気と入れ替わることを意味しています。日常生活を送っている一般住宅における換気回数は、春、夏、秋、冬で1.2、1.7、0.6、0.6回/hという報告があり、春や夏で換気回数が高くなっているのは窓開け時間が長いためだとされています20)。海外(中国)の調査でも、窓開け換気をしている住宅としていない住宅では、3.5回/hと0.8回/h(夏季)及び2.5回/hと0.5回/h(年間)と、換気回数に大きな違いがみられています21)。室内で一度のPM2.5発生があった場合には、10分以内の窓開け換気で室内のPM2.5濃度は外気レベル以下に落ちるとされています22)。窓を開けている場合でも、外気の風速と風向や窓の形状によって換気回数は0.5回/hから数10回/hと大きく変わりうることがモデル計算によって報告されており23)、窓開けをしても換気量が大きく上昇しないこともありえます。
MERS患者の病室における感染リスクを評価した研究では、看護師や医療従事者や家族など近くで患者と接する人の感染リスクは、換気回数が6回/hから12回/hに増えても数%しか減らない一方で、同室の離れた場所にいる他の患者のリスクは半分近くまで減少すると推定されています24)。
一般住宅で日常生活を送っている時の換気回数では、数μm以下の粒子に対しては、数十分~数時間曝露され続けることとなります。このことから、定常的もしくは断続的に発生が想定される場合には、常時窓開けをしておくことが望ましいです。ただし、季節や部屋の目的によっては常時の窓開けが困難なケースも考えられます。そのような場合には、一定時間ごとの窓開け換気をすることとなりますが、曝露を減らす対策としては不十分な可能性もあります。
換気によって屋外に排出された空気中にウイルスが含まれている場合も、多くの場合は外気によって非常に高倍率で希釈されるため、屋外での感染には寄与しないと考えられます。ただし、排気口のすぐそばに喫煙所などの人が集まる場所がある場合や、排気口のすぐそばに吸気口がある場合などには、注意が必要なケースもあるかもしれません。
【室内空気の清浄化】
フィルターによる粒径別粒子の捕集効率は、0.1 μm前後で非常に低く、数 μm以上や0.01 μm以下では非常に高いとされています25)。ただし、粒子捕集効率はフィルターによって大きく異なっており、40% ASHRAEフィルター、85% ASHRAEフィルター、標準ファーネスフィルターの粒子捕集効率は、10 nm以下の粒子では、それぞれ40%–100%、40%–100%、100%、数10 nm–数100 nmの粒子で10%以下、20%以下、40%–80%、数 μm以上の粒子では80%–100%、100%、100%だったという報告もあります25)。(ASHRAEは、アメリカ暖房冷凍空調学会のことで、空調システムや換気などに関する各種規格の策定もしている組織です。40%と85%は、研究された当時のASHRAEの規格での粒子の捕集効率と思われます)。静電フィルターでは、これらのサブミクロン領域の低捕集効率が改善され、0.03–0.6 μmの粒子の捕集効率は、市販のHEPAフィルターでそれ以上ではほぼ100%(0.03 μmのみ97%程度、放電状態では40%–90%)、作成したCMフィルターで85%以上(放電状態では30%–80%)、市販のMERV13フィルターで60%以上(放電状態では数%–25%)と向上したとされています26)(HEPAフィルターは、JIS(日本工業規格)で粒径0.3 µmの粒子の捕集効率が99.97%以上とされるフィルターです。CMフィルターはこの研究において作成された市販でない複合素材でのフィルターです。MERVは、米国のフィルターの規格(ASHRAE 52.2 (2007))でMERV 1からMERV 16まであり、MERVE13は0.3–1 μmの粒子の捕集効率が75%以下とされているものです。ちなみに、MERVE16は、0.3–1 μmの粒子の捕集効率が95%以上とされています)。市販の空気清浄機は、数m3/分から10 m3/分のため、HEPAフィルターが搭載されているものであれば、12畳の部屋で3–15回/h程度の換気に相当する可能性があります。HVACシステムでフィルターを通して空気清浄化を行った場合(循環回数0.8–0.9回/h)、咳を模した装置から発生するウイルス(バクテリオファージ T4)の気中濃度は、0.5 m離れた位置では3種類のどのフィルターでも20%程度しか減少せず、3 m離れた位置では20%–80%、5 m離れた位置では70%–98%、12%–92%とフィルターごとに大きく異なる効率で減少します27)(HVACシステムは、暖房・換気・エアコンの機能を一体化したシステム)。HEPAフィルターを搭載した大型の空気清浄化システムを使用した場合(51回/h)、ウイルス(バクテリオファージ MS2)を含むエアロゾル発生器から発生させたウイルスはバクテリアやカビよりは除去効率が低いものの、95%が除去されたとする報告もあります28)。ただし、HEPAフィルターも製品によって性能に違いがあることやウイルスの種類によって効果が小さい場合もありうることには注意が必要です。これらのことから、空気清浄機を使用する場合にも、換気との併用が望ましいと思われます。また、フィルターの取り換え時の曝露が懸念されるため、フィルターの交換は手袋やマスクをした上で、屋外において行うことが望ましいでしょう。
【室内における沈着と再飛散】
大きな粒子では重力沈降により床面に沈着したり移流により壁面に沈着したりすることが多く、小さな粒子では拡散により床面だけでなく天井や壁面や家具などの表面に沈着することが多いとされています。100 μm, 10 μm, 0.1 μmの粒子の床面に沈着する割合は43%–79%、0.6%–18%、2.5%–18%と仮定でき、壁面に沈着する割合は8.7%–47%、51%–86%、51%–89%と仮定できるとしている研究もあります15)。
大きい飛沫は重力沈降により数秒から15秒程度で床面に沈着しますが、小さい粒子はより長時間空気中を漂っています14)。ウイルス(バクテリオファージ T4)の床面への沈着は、大きな大腸菌のケースと違い、咳をした近く(0.5 m)では少なく、3 m離れた位置で高く、5 m離れた地点でも0.5 mの地点より高かったという報告があり27)、感染者から少し離れた場所で床面に沈着する量が多いと思われます。ちなみに、温度21–23°C相対湿度40%の実験室で行った実験では、銅、段ボール紙、ステンレス鋼、プラスチックの表面における新型コロナウイルス(SARS-CoV-2)の不活化の半減期の中央値は、0.77時間、3.5時間、5.6時間、6.8時間とされており、最大では48時間後のステンレス鋼表面(初期値の0.8%)や72時間後のプラスチック表面(初期値の2%)でもウイルスの活性が確認されたとされており19)、沈着後もしばらくは活性を維持していると考えられます。他にも、温度22°C相対湿度65%の実験室において、新型コロナウイルス(SARS-CoV-2)を含む液を表面に滴下したところ、印刷用紙とティッシュペーパでは3時間後まで、木材や布は2日後まで、ガラスや紙幣は4日後まで、ステンレス鋼やプラスチックは7日後まで活性を有していた(初期値の~0.1%)とする報告もあります29)。ただし、これらは実験室内でコントロールされた条件下の試験であり、実環境中では温度・湿度・紫外線の影響をウイルスが受けうることや、ウイルスの活性を調べているがヒトへ感染するかどうかを調べている試験ではない、という点には注意が必要です。実環境における報告では、新型コロナウイルス(SARS-CoV-2)の患者の病室において、ドアノブやベッドレールなどの手の触れるところだけでなく、床や窓や排気ファンなど沈着したと考えられる箇所からもウイルスが検出されています5,12)。室内の床面や各種表面に沈着したウイルスからの接触感染の可能性もあるため、床面やテーブルやドアノブ等の表面について消毒用エタノールや適切に希釈した次亜塩素酸ナトリウム液を使用した殺菌処理を定期的に行うことが必要と考えられます。ただし、次亜塩素酸ナトリウムは、皮膚に対する刺激があり、また消毒した表面に腐食や変色を起こす可能性があります。
室内の床面上のダストは、歩行やドアの開閉や掃除などの人の活動によって再飛散(巻き上げられること)が起こります30)。ダストのサイズ・性状や床面の材質や環境条件によって、再飛散率は大きく異なりますが、金属粒子などのダストの再飛散率は0.000001%–0.1%、カビやバクテリアなどの再飛散率は0.0001%–0.1%とされています30)。再飛散率が高くないためか、ウイルス(バクテリオファージ T4)を用いた試験では、ウイルスが検出された床上を歩いた時に、気中からウイルスは検出されませんでした27)。

【さいごに】
感染者が呼吸・会話・咳・くしゃみなどをすると、ウイルスを含む飛沫が環境中に飛散します。会話や咳で飛散する大きな粒子は、多くの場合2 m以内に床面に沈着しますが、室内の気流によっては5 m程度飛散することもあります。また、飛沫核などの小さな粒子は、沈着せずに数時間もしくはそれ以上室内を漂う可能性もあります。室内空気中からウイルスが除去される経路としては、床面や壁面への沈着、換気による屋外への排出、ウイルスの不活化があります。10 μmを超えるサイズの粒子ではほぼ沈着で除去されますが、数μm以下の粒子では換気と不活化の寄与が大きいと考えられます。室内を漂うエアロゾル上の新型コロナウイルスの不活化の半減期は1.1時間程度という報告があることから、換気をしなければ1時間後でも半分のウイルスは活性を持っている可能性があると考えられます。さらに、日本の一般家屋の日常生活時の換気回数は、春夏で1.2–1.7回/h、秋冬で0.6回/h程度であり、病室などで感染対策として取られる換気回数よりはるかに低いため、室内濃度をより効率的に低減させるためには窓開け換気が推奨されます。ただし、屋外の風向や風速によっては、窓開け換気でも十分な換気量が得られないケースもあると思われます。空気清浄機については、コロナウイルスについての研究はありませんが、ウイルスについては一定の効果が認められているため、有用であると思われますが、換気との併用が望ましいでしょう。マスクについては、感染者からの感染リスク低減に効果があると思われるため、着用が望ましいと考えられますが、それらの研究の整理については、別の機会に譲りたいと思います。また、本稿では対象としませんでしたが、接触感染の防止のために、うがいや手洗いを徹底することが、感染防止の観点からも非常に大事だと考えられます。
※ WHOにおける用語の定義1)
- 接触感染
(contact transmission) 直接接触(direct contact)と間接接触 (indirect contact)による感染(transmission)
- 飛沫感染
(droplet transmission) 主に<1 mの距離で生じる飛沫(droplet)による感染
- 空気感染
(airborne transmission) 飛沫核(droplet nuclei)の飛散・吸入による感染
- 飛沫
(droplet) 5 μmより大きい吸入性エアロゾル
- 飛沫核
(droplet nuclei) 5 μmより小さい吸入性エアロゾルで飛沫が乾燥した吸入性エアロゾル残渣(residue of dried respiratory aerosols)
- 感染性吸入性エアロゾル
(infectious respiratory aerosols) 吸入可能なサイズの感染性の飛沫と飛沫核
【謝辞】本稿は、公開に先駆けて、室内環境学会学術委員会によりコメントをいただき、修正いたしました。学術委員会の川上裕司先生(株式会社エフシージー総合研究所)、清水一男先生(静岡大学)、池田四郎先生(株式会社ガステック)、野﨑淳夫先生(東北文化学園大学大学院)、中島大介先生(国立研究開発法人国立環境研究所)、北條祥子先生(東北大学大学院歯学研究科)、水越厚史先生(近畿大学医学部)、徳村雅弘先生(静岡県立大学)、高木麻衣先生(国立研究開発法人国立環境研究所)、理事会の関根嘉香先生(東海大学)、山口一先生(大同大学)、鍵直樹先生(東京工業大学)、三宅祐一先生(静岡県立大学)に深く感謝申し上げます。
【引用文献】
- World Health Organization: Infection prevention and control of epidemic- and pandemic-prone acute respiratory infections in health care. Geneva: World Health Organization (2014) https://apps.who.int/iris/bitstream/handle/10665/112656/9789241507134_eng.pdf?sequence=1
- Chan J et al.: A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet, 395: 514–523. (2020)
- Li Q et al.: Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia. The New England Journal of Medicine, 382: 1199–1207. (2020)
- Huang C et al. : Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, 395: 497–506. (2020)
- Ong SWX et al.: Air, Surface Environmental, and Personal Protective Equipment Contamination by Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) From a Symptomatic Patient. JAMA, E1–E3 (2020)
- World Health Organization: Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19) 16-24 February 2020. (2020) https://www.who.int/docs/default-source/coronaviruse/who-china-joint-mission-on-covid-19-final-report.pdf
- Bella J et al.: Review: Rhinoviruses and their ICAM receptors. Journal of Structural Biology, 128: 69–74. (1999)
- Noda T: Native morphology of influenza virions. Frontiers in Microbiology, 3: 269. (2012)
- Chen N et al.: Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet, 395: 507-513. (2020)
- Johnson GR et al.: Modality of human expired aerosol size distributions. Journal of Aerosol Science. 42: 839-851. (2011)
- Lindsley WG et al.: Quantity and Size Distribution of Cough-Generated Aerosol Particles Produced by Influenza Patients During and After Illness. Journal of Occupational and Environmental Hygiene, 9: 443–449. (2012)
- Chia PY et al.: Detection of Air and Surface Contamination by Severe Acute Respiratory Syndrome 1 Coronavirus 2 (SARS-CoV-2) in Hospital Rooms of Infected Patients. (Preprint from BioRXiv) (2020) https://doi.org/10.1101/2020.03.29.20046557
- Liu Y et al.: Aerodynamic Characteristics and RNA Concentration of SARS-CoV-2 Aerosol in Wuhan Hospitals during COVID-19 Outbreak. (Preprint from BioRXiv). (2020) https://doi.org/10.1101/2020.03.08.982637
- Xie X et al.: How far droplets can move in indoor environments – revisiting the Wells evaporation–falling curve. Indoor air. 17: 211–225. (2007)
- Chen C and Zhao B: Some questions on dispersion of human exhaled droplets in ventilation room: answers from numerical investigation. Indoor Air, 20: 95-111. (2010)
- Morawska L et al.: Size distribution and sites of origin of droplets expelled from the human respiratory tract during expiratory activities. Journal of Aerosol Science. 40, 256–269. (2009)
- Nicas M et al.: Toward understanding the risk of secondary airborne infection: emission of respirable pathogens, Journal of Occupational and Environmental Hygiene, 2, 143–154. (2005)
- Yang W and Marr LC: Dynamics of Airborne Influenza A Viruses Indoors and Dependence on Humidity. PlosOne, 6: e21481. (2011)
- van Doremalen N et al.: Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England Journal of Medicine (in print) https://www.nejm.org/doi/pdf/10.1056/NEJMc2004973
- Shinohara N et al.: Distribution and variability of the 24-h average air exchange rates and interzonal flow rates in 26 Japanese residences over 5 seasons. Atmospheric Environment, 45: 3548–3552. (2011)
- Hou J et al.: Air change rates at night in northeast Chinese homes. Building and Environment, 132: 273–281. (2018)
- Xiao Y et al.: Effects of source emission and window opening on winter indoor particle concentrations in the severe cold region of China. Building and Environment, 144: 23–33. (2018)
- Wang J et al.: Numerical investigation of single-sided natural ventilation driven by buoyancy and wind through variable window configurations. Energy and Buildings, 168: 147–164. (2018)
- Adhikari U et al.: A Case Study Evaluating the Risk of Infection from Middle Eastern Respiratory Syndrome Coronavirus (MERS-CoV) in a Hospital Setting Through Bioaerosols. Risk Analysis, 39: 2608–2624. (2019)
- Riley WJ et al.: Indoor particulate matter of outdoor origin: Importance of size-dependent removal mechanisms. Environmental Science & Technology, 36: 200–207. (2002)
- Li, S et al.: Effects of relative humidity and particle hygroscopicity on the initial efficiency and aging characteristics of electret HVAC filter media. Building and Environment, 171: 106669. (2020)
- Kunkel SA et al.: Quantifying the size-resolved dynamics of indoor bioaerosol transport and control. Indoor Air, 27: 977–987. (2017)
- Foarde KK et al.: Q Development of a method for measuring single-pass bioaerosol removal efficiencies of a room air cleaner. Aerosol Science and Technology, 30: 223–234. (1999)
- Chin AWH et al.: Stability of SARS-CoV-2 in different environmental conditions. Lancet microbe, (2020) https://doi.org/10.1016/S2666-5247(20)30003-3
- Qian J et al.: Walking-induced particle resuspension in indoor environments. Atmospheric environment, 89: 464–481. (2014)
日本の住宅は、建築基準法で新築時に0.5回/h以上の機械換気設備の設置が義務付けられています。換気回数とは、1時間あたり部屋の空気のどのくらいが外気と交換されるかを示すもので、0.5回/hは、1時間で室内の空気の半分が外気と入れ替わることを意味しています。日常生活を送っている一般住宅における換気回数は、春、夏、秋、冬で1.2、1.7、0.6、0.6回/hという報告があり、春や夏で換気回数が高くなっているのは窓開け時間が長いためだとされています20)。海外(中国)の調査でも、窓開け換気をしている住宅としていない住宅では、3.5回/hと0.8回/h(夏季)及び2.5回/hと0.5回/h(年間)と、換気回数に大きな違いがみられています21)。室内で一度のPM2.5発生があった場合には、10分以内の窓開け換気で室内のPM2.5濃度は外気レベル以下に落ちるとされています22)。窓を開けている場合でも、外気の風速と風向や窓の形状によって換気回数は0.5回/hから数10回/hと大きく変わりうることがモデル計算によって報告されており23)、窓開けをしても換気量が大きく上昇しないこともありえます。
MERS患者の病室における感染リスクを評価した研究では、看護師や医療従事者や家族など近くで患者と接する人の感染リスクは、換気回数が6回/hから12回/hに増えても数%しか減らない一方で、同室の離れた場所にいる他の患者のリスクは半分近くまで減少すると推定されています24)。
一般住宅で日常生活を送っている時の換気回数では、数μm以下の粒子に対しては、数十分~数時間曝露され続けることとなります。このことから、定常的もしくは断続的に発生が想定される場合には、常時窓開けをしておくことが望ましいです。ただし、季節や部屋の目的によっては常時の窓開けが困難なケースも考えられます。そのような場合には、一定時間ごとの窓開け換気をすることとなりますが、曝露を減らす対策としては不十分な可能性もあります。
換気によって屋外に排出された空気中にウイルスが含まれている場合も、多くの場合は外気によって非常に高倍率で希釈されるため、屋外での感染には寄与しないと考えられます。ただし、排気口のすぐそばに喫煙所などの人が集まる場所がある場合や、排気口のすぐそばに吸気口がある場合などには、注意が必要なケースもあるかもしれません。
MERS患者の病室における感染リスクを評価した研究では、看護師や医療従事者や家族など近くで患者と接する人の感染リスクは、換気回数が6回/hから12回/hに増えても数%しか減らない一方で、同室の離れた場所にいる他の患者のリスクは半分近くまで減少すると推定されています24)。
一般住宅で日常生活を送っている時の換気回数では、数μm以下の粒子に対しては、数十分~数時間曝露され続けることとなります。このことから、定常的もしくは断続的に発生が想定される場合には、常時窓開けをしておくことが望ましいです。ただし、季節や部屋の目的によっては常時の窓開けが困難なケースも考えられます。そのような場合には、一定時間ごとの窓開け換気をすることとなりますが、曝露を減らす対策としては不十分な可能性もあります。
換気によって屋外に排出された空気中にウイルスが含まれている場合も、多くの場合は外気によって非常に高倍率で希釈されるため、屋外での感染には寄与しないと考えられます。ただし、排気口のすぐそばに喫煙所などの人が集まる場所がある場合や、排気口のすぐそばに吸気口がある場合などには、注意が必要なケースもあるかもしれません。
【室内空気の清浄化】
フィルターによる粒径別粒子の捕集効率は、0.1 μm前後で非常に低く、数 μm以上や0.01 μm以下では非常に高いとされています25)。ただし、粒子捕集効率はフィルターによって大きく異なっており、40% ASHRAEフィルター、85% ASHRAEフィルター、標準ファーネスフィルターの粒子捕集効率は、10 nm以下の粒子では、それぞれ40%–100%、40%–100%、100%、数10 nm–数100 nmの粒子で10%以下、20%以下、40%–80%、数 μm以上の粒子では80%–100%、100%、100%だったという報告もあります25)。(ASHRAEは、アメリカ暖房冷凍空調学会のことで、空調システムや換気などに関する各種規格の策定もしている組織です。40%と85%は、研究された当時のASHRAEの規格での粒子の捕集効率と思われます)。静電フィルターでは、これらのサブミクロン領域の低捕集効率が改善され、0.03–0.6 μmの粒子の捕集効率は、市販のHEPAフィルターでそれ以上ではほぼ100%(0.03 μmのみ97%程度、放電状態では40%–90%)、作成したCMフィルターで85%以上(放電状態では30%–80%)、市販のMERV13フィルターで60%以上(放電状態では数%–25%)と向上したとされています26)(HEPAフィルターは、JIS(日本工業規格)で粒径0.3 µmの粒子の捕集効率が99.97%以上とされるフィルターです。CMフィルターはこの研究において作成された市販でない複合素材でのフィルターです。MERVは、米国のフィルターの規格(ASHRAE 52.2 (2007))でMERV 1からMERV 16まであり、MERVE13は0.3–1 μmの粒子の捕集効率が75%以下とされているものです。ちなみに、MERVE16は、0.3–1 μmの粒子の捕集効率が95%以上とされています)。市販の空気清浄機は、数m3/分から10 m3/分のため、HEPAフィルターが搭載されているものであれば、12畳の部屋で3–15回/h程度の換気に相当する可能性があります。HVACシステムでフィルターを通して空気清浄化を行った場合(循環回数0.8–0.9回/h)、咳を模した装置から発生するウイルス(バクテリオファージ T4)の気中濃度は、0.5 m離れた位置では3種類のどのフィルターでも20%程度しか減少せず、3 m離れた位置では20%–80%、5 m離れた位置では70%–98%、12%–92%とフィルターごとに大きく異なる効率で減少します27)(HVACシステムは、暖房・換気・エアコンの機能を一体化したシステム)。HEPAフィルターを搭載した大型の空気清浄化システムを使用した場合(51回/h)、ウイルス(バクテリオファージ MS2)を含むエアロゾル発生器から発生させたウイルスはバクテリアやカビよりは除去効率が低いものの、95%が除去されたとする報告もあります28)。ただし、HEPAフィルターも製品によって性能に違いがあることやウイルスの種類によって効果が小さい場合もありうることには注意が必要です。これらのことから、空気清浄機を使用する場合にも、換気との併用が望ましいと思われます。また、フィルターの取り換え時の曝露が懸念されるため、フィルターの交換は手袋やマスクをした上で、屋外において行うことが望ましいでしょう。
【室内における沈着と再飛散】
大きな粒子では重力沈降により床面に沈着したり移流により壁面に沈着したりすることが多く、小さな粒子では拡散により床面だけでなく天井や壁面や家具などの表面に沈着することが多いとされています。100 μm, 10 μm, 0.1 μmの粒子の床面に沈着する割合は43%–79%、0.6%–18%、2.5%–18%と仮定でき、壁面に沈着する割合は8.7%–47%、51%–86%、51%–89%と仮定できるとしている研究もあります15)。
大きい飛沫は重力沈降により数秒から15秒程度で床面に沈着しますが、小さい粒子はより長時間空気中を漂っています14)。ウイルス(バクテリオファージ T4)の床面への沈着は、大きな大腸菌のケースと違い、咳をした近く(0.5 m)では少なく、3 m離れた位置で高く、5 m離れた地点でも0.5 mの地点より高かったという報告があり27)、感染者から少し離れた場所で床面に沈着する量が多いと思われます。ちなみに、温度21–23°C相対湿度40%の実験室で行った実験では、銅、段ボール紙、ステンレス鋼、プラスチックの表面における新型コロナウイルス(SARS-CoV-2)の不活化の半減期の中央値は、0.77時間、3.5時間、5.6時間、6.8時間とされており、最大では48時間後のステンレス鋼表面(初期値の0.8%)や72時間後のプラスチック表面(初期値の2%)でもウイルスの活性が確認されたとされており19)、沈着後もしばらくは活性を維持していると考えられます。他にも、温度22°C相対湿度65%の実験室において、新型コロナウイルス(SARS-CoV-2)を含む液を表面に滴下したところ、印刷用紙とティッシュペーパでは3時間後まで、木材や布は2日後まで、ガラスや紙幣は4日後まで、ステンレス鋼やプラスチックは7日後まで活性を有していた(初期値の~0.1%)とする報告もあります29)。ただし、これらは実験室内でコントロールされた条件下の試験であり、実環境中では温度・湿度・紫外線の影響をウイルスが受けうることや、ウイルスの活性を調べているがヒトへ感染するかどうかを調べている試験ではない、という点には注意が必要です。実環境における報告では、新型コロナウイルス(SARS-CoV-2)の患者の病室において、ドアノブやベッドレールなどの手の触れるところだけでなく、床や窓や排気ファンなど沈着したと考えられる箇所からもウイルスが検出されています5,12)。室内の床面や各種表面に沈着したウイルスからの接触感染の可能性もあるため、床面やテーブルやドアノブ等の表面について消毒用エタノールや適切に希釈した次亜塩素酸ナトリウム液を使用した殺菌処理を定期的に行うことが必要と考えられます。ただし、次亜塩素酸ナトリウムは、皮膚に対する刺激があり、また消毒した表面に腐食や変色を起こす可能性があります。
室内の床面上のダストは、歩行やドアの開閉や掃除などの人の活動によって再飛散(巻き上げられること)が起こります30)。ダストのサイズ・性状や床面の材質や環境条件によって、再飛散率は大きく異なりますが、金属粒子などのダストの再飛散率は0.000001%–0.1%、カビやバクテリアなどの再飛散率は0.0001%–0.1%とされています30)。再飛散率が高くないためか、ウイルス(バクテリオファージ T4)を用いた試験では、ウイルスが検出された床上を歩いた時に、気中からウイルスは検出されませんでした27)。

【さいごに】
感染者が呼吸・会話・咳・くしゃみなどをすると、ウイルスを含む飛沫が環境中に飛散します。会話や咳で飛散する大きな粒子は、多くの場合2 m以内に床面に沈着しますが、室内の気流によっては5 m程度飛散することもあります。また、飛沫核などの小さな粒子は、沈着せずに数時間もしくはそれ以上室内を漂う可能性もあります。室内空気中からウイルスが除去される経路としては、床面や壁面への沈着、換気による屋外への排出、ウイルスの不活化があります。10 μmを超えるサイズの粒子ではほぼ沈着で除去されますが、数μm以下の粒子では換気と不活化の寄与が大きいと考えられます。室内を漂うエアロゾル上の新型コロナウイルスの不活化の半減期は1.1時間程度という報告があることから、換気をしなければ1時間後でも半分のウイルスは活性を持っている可能性があると考えられます。さらに、日本の一般家屋の日常生活時の換気回数は、春夏で1.2–1.7回/h、秋冬で0.6回/h程度であり、病室などで感染対策として取られる換気回数よりはるかに低いため、室内濃度をより効率的に低減させるためには窓開け換気が推奨されます。ただし、屋外の風向や風速によっては、窓開け換気でも十分な換気量が得られないケースもあると思われます。空気清浄機については、コロナウイルスについての研究はありませんが、ウイルスについては一定の効果が認められているため、有用であると思われますが、換気との併用が望ましいでしょう。マスクについては、感染者からの感染リスク低減に効果があると思われるため、着用が望ましいと考えられますが、それらの研究の整理については、別の機会に譲りたいと思います。また、本稿では対象としませんでしたが、接触感染の防止のために、うがいや手洗いを徹底することが、感染防止の観点からも非常に大事だと考えられます。
※ WHOにおける用語の定義1)
- 接触感染
(contact transmission) 直接接触(direct contact)と間接接触 (indirect contact)による感染(transmission)
- 飛沫感染
(droplet transmission) 主に<1 mの距離で生じる飛沫(droplet)による感染
- 空気感染
(airborne transmission) 飛沫核(droplet nuclei)の飛散・吸入による感染
- 飛沫
(droplet) 5 μmより大きい吸入性エアロゾル
- 飛沫核
(droplet nuclei) 5 μmより小さい吸入性エアロゾルで飛沫が乾燥した吸入性エアロゾル残渣(residue of dried respiratory aerosols)
- 感染性吸入性エアロゾル
(infectious respiratory aerosols) 吸入可能なサイズの感染性の飛沫と飛沫核
【謝辞】本稿は、公開に先駆けて、室内環境学会学術委員会によりコメントをいただき、修正いたしました。学術委員会の川上裕司先生(株式会社エフシージー総合研究所)、清水一男先生(静岡大学)、池田四郎先生(株式会社ガステック)、野﨑淳夫先生(東北文化学園大学大学院)、中島大介先生(国立研究開発法人国立環境研究所)、北條祥子先生(東北大学大学院歯学研究科)、水越厚史先生(近畿大学医学部)、徳村雅弘先生(静岡県立大学)、高木麻衣先生(国立研究開発法人国立環境研究所)、理事会の関根嘉香先生(東海大学)、山口一先生(大同大学)、鍵直樹先生(東京工業大学)、三宅祐一先生(静岡県立大学)に深く感謝申し上げます。
【引用文献】
- World Health Organization: Infection prevention and control of epidemic- and pandemic-prone acute respiratory infections in health care. Geneva: World Health Organization (2014) https://apps.who.int/iris/bitstream/handle/10665/112656/9789241507134_eng.pdf?sequence=1
- Chan J et al.: A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet, 395: 514–523. (2020)
- Li Q et al.: Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia. The New England Journal of Medicine, 382: 1199–1207. (2020)
- Huang C et al. : Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, 395: 497–506. (2020)
- Ong SWX et al.: Air, Surface Environmental, and Personal Protective Equipment Contamination by Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) From a Symptomatic Patient. JAMA, E1–E3 (2020)
- World Health Organization: Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19) 16-24 February 2020. (2020) https://www.who.int/docs/default-source/coronaviruse/who-china-joint-mission-on-covid-19-final-report.pdf
- Bella J et al.: Review: Rhinoviruses and their ICAM receptors. Journal of Structural Biology, 128: 69–74. (1999)
- Noda T: Native morphology of influenza virions. Frontiers in Microbiology, 3: 269. (2012)
- Chen N et al.: Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet, 395: 507-513. (2020)
- Johnson GR et al.: Modality of human expired aerosol size distributions. Journal of Aerosol Science. 42: 839-851. (2011)
- Lindsley WG et al.: Quantity and Size Distribution of Cough-Generated Aerosol Particles Produced by Influenza Patients During and After Illness. Journal of Occupational and Environmental Hygiene, 9: 443–449. (2012)
- Chia PY et al.: Detection of Air and Surface Contamination by Severe Acute Respiratory Syndrome 1 Coronavirus 2 (SARS-CoV-2) in Hospital Rooms of Infected Patients. (Preprint from BioRXiv) (2020) https://doi.org/10.1101/2020.03.29.20046557
- Liu Y et al.: Aerodynamic Characteristics and RNA Concentration of SARS-CoV-2 Aerosol in Wuhan Hospitals during COVID-19 Outbreak. (Preprint from BioRXiv). (2020) https://doi.org/10.1101/2020.03.08.982637
- Xie X et al.: How far droplets can move in indoor environments – revisiting the Wells evaporation–falling curve. Indoor air. 17: 211–225. (2007)
- Chen C and Zhao B: Some questions on dispersion of human exhaled droplets in ventilation room: answers from numerical investigation. Indoor Air, 20: 95-111. (2010)
- Morawska L et al.: Size distribution and sites of origin of droplets expelled from the human respiratory tract during expiratory activities. Journal of Aerosol Science. 40, 256–269. (2009)
- Nicas M et al.: Toward understanding the risk of secondary airborne infection: emission of respirable pathogens, Journal of Occupational and Environmental Hygiene, 2, 143–154. (2005)
- Yang W and Marr LC: Dynamics of Airborne Influenza A Viruses Indoors and Dependence on Humidity. PlosOne, 6: e21481. (2011)
- van Doremalen N et al.: Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England Journal of Medicine (in print) https://www.nejm.org/doi/pdf/10.1056/NEJMc2004973
- Shinohara N et al.: Distribution and variability of the 24-h average air exchange rates and interzonal flow rates in 26 Japanese residences over 5 seasons. Atmospheric Environment, 45: 3548–3552. (2011)
- Hou J et al.: Air change rates at night in northeast Chinese homes. Building and Environment, 132: 273–281. (2018)
- Xiao Y et al.: Effects of source emission and window opening on winter indoor particle concentrations in the severe cold region of China. Building and Environment, 144: 23–33. (2018)
- Wang J et al.: Numerical investigation of single-sided natural ventilation driven by buoyancy and wind through variable window configurations. Energy and Buildings, 168: 147–164. (2018)
- Adhikari U et al.: A Case Study Evaluating the Risk of Infection from Middle Eastern Respiratory Syndrome Coronavirus (MERS-CoV) in a Hospital Setting Through Bioaerosols. Risk Analysis, 39: 2608–2624. (2019)
- Riley WJ et al.: Indoor particulate matter of outdoor origin: Importance of size-dependent removal mechanisms. Environmental Science & Technology, 36: 200–207. (2002)
- Li, S et al.: Effects of relative humidity and particle hygroscopicity on the initial efficiency and aging characteristics of electret HVAC filter media. Building and Environment, 171: 106669. (2020)
- Kunkel SA et al.: Quantifying the size-resolved dynamics of indoor bioaerosol transport and control. Indoor Air, 27: 977–987. (2017)
- Foarde KK et al.: Q Development of a method for measuring single-pass bioaerosol removal efficiencies of a room air cleaner. Aerosol Science and Technology, 30: 223–234. (1999)
- Chin AWH et al.: Stability of SARS-CoV-2 in different environmental conditions. Lancet microbe, (2020) https://doi.org/10.1016/S2666-5247(20)30003-3
- Qian J et al.: Walking-induced particle resuspension in indoor environments. Atmospheric environment, 89: 464–481. (2014)
フィルターによる粒径別粒子の捕集効率は、0.1 μm前後で非常に低く、数 μm以上や0.01 μm以下では非常に高いとされています25)。ただし、粒子捕集効率はフィルターによって大きく異なっており、40% ASHRAEフィルター、85% ASHRAEフィルター、標準ファーネスフィルターの粒子捕集効率は、10 nm以下の粒子では、それぞれ40%–100%、40%–100%、100%、数10 nm–数100 nmの粒子で10%以下、20%以下、40%–80%、数 μm以上の粒子では80%–100%、100%、100%だったという報告もあります25)。(ASHRAEは、アメリカ暖房冷凍空調学会のことで、空調システムや換気などに関する各種規格の策定もしている組織です。40%と85%は、研究された当時のASHRAEの規格での粒子の捕集効率と思われます)。静電フィルターでは、これらのサブミクロン領域の低捕集効率が改善され、0.03–0.6 μmの粒子の捕集効率は、市販のHEPAフィルターでそれ以上ではほぼ100%(0.03 μmのみ97%程度、放電状態では40%–90%)、作成したCMフィルターで85%以上(放電状態では30%–80%)、市販のMERV13フィルターで60%以上(放電状態では数%–25%)と向上したとされています26)(HEPAフィルターは、JIS(日本工業規格)で粒径0.3 µmの粒子の捕集効率が99.97%以上とされるフィルターです。CMフィルターはこの研究において作成された市販でない複合素材でのフィルターです。MERVは、米国のフィルターの規格(ASHRAE 52.2 (2007))でMERV 1からMERV 16まであり、MERVE13は0.3–1 μmの粒子の捕集効率が75%以下とされているものです。ちなみに、MERVE16は、0.3–1 μmの粒子の捕集効率が95%以上とされています)。市販の空気清浄機は、数m3/分から10 m3/分のため、HEPAフィルターが搭載されているものであれば、12畳の部屋で3–15回/h程度の換気に相当する可能性があります。HVACシステムでフィルターを通して空気清浄化を行った場合(循環回数0.8–0.9回/h)、咳を模した装置から発生するウイルス(バクテリオファージ T4)の気中濃度は、0.5 m離れた位置では3種類のどのフィルターでも20%程度しか減少せず、3 m離れた位置では20%–80%、5 m離れた位置では70%–98%、12%–92%とフィルターごとに大きく異なる効率で減少します27)(HVACシステムは、暖房・換気・エアコンの機能を一体化したシステム)。HEPAフィルターを搭載した大型の空気清浄化システムを使用した場合(51回/h)、ウイルス(バクテリオファージ MS2)を含むエアロゾル発生器から発生させたウイルスはバクテリアやカビよりは除去効率が低いものの、95%が除去されたとする報告もあります28)。ただし、HEPAフィルターも製品によって性能に違いがあることやウイルスの種類によって効果が小さい場合もありうることには注意が必要です。これらのことから、空気清浄機を使用する場合にも、換気との併用が望ましいと思われます。また、フィルターの取り換え時の曝露が懸念されるため、フィルターの交換は手袋やマスクをした上で、屋外において行うことが望ましいでしょう。
【室内における沈着と再飛散】
大きな粒子では重力沈降により床面に沈着したり移流により壁面に沈着したりすることが多く、小さな粒子では拡散により床面だけでなく天井や壁面や家具などの表面に沈着することが多いとされています。100 μm, 10 μm, 0.1 μmの粒子の床面に沈着する割合は43%–79%、0.6%–18%、2.5%–18%と仮定でき、壁面に沈着する割合は8.7%–47%、51%–86%、51%–89%と仮定できるとしている研究もあります15)。
大きい飛沫は重力沈降により数秒から15秒程度で床面に沈着しますが、小さい粒子はより長時間空気中を漂っています14)。ウイルス(バクテリオファージ T4)の床面への沈着は、大きな大腸菌のケースと違い、咳をした近く(0.5 m)では少なく、3 m離れた位置で高く、5 m離れた地点でも0.5 mの地点より高かったという報告があり27)、感染者から少し離れた場所で床面に沈着する量が多いと思われます。ちなみに、温度21–23°C相対湿度40%の実験室で行った実験では、銅、段ボール紙、ステンレス鋼、プラスチックの表面における新型コロナウイルス(SARS-CoV-2)の不活化の半減期の中央値は、0.77時間、3.5時間、5.6時間、6.8時間とされており、最大では48時間後のステンレス鋼表面(初期値の0.8%)や72時間後のプラスチック表面(初期値の2%)でもウイルスの活性が確認されたとされており19)、沈着後もしばらくは活性を維持していると考えられます。他にも、温度22°C相対湿度65%の実験室において、新型コロナウイルス(SARS-CoV-2)を含む液を表面に滴下したところ、印刷用紙とティッシュペーパでは3時間後まで、木材や布は2日後まで、ガラスや紙幣は4日後まで、ステンレス鋼やプラスチックは7日後まで活性を有していた(初期値の~0.1%)とする報告もあります29)。ただし、これらは実験室内でコントロールされた条件下の試験であり、実環境中では温度・湿度・紫外線の影響をウイルスが受けうることや、ウイルスの活性を調べているがヒトへ感染するかどうかを調べている試験ではない、という点には注意が必要です。実環境における報告では、新型コロナウイルス(SARS-CoV-2)の患者の病室において、ドアノブやベッドレールなどの手の触れるところだけでなく、床や窓や排気ファンなど沈着したと考えられる箇所からもウイルスが検出されています5,12)。室内の床面や各種表面に沈着したウイルスからの接触感染の可能性もあるため、床面やテーブルやドアノブ等の表面について消毒用エタノールや適切に希釈した次亜塩素酸ナトリウム液を使用した殺菌処理を定期的に行うことが必要と考えられます。ただし、次亜塩素酸ナトリウムは、皮膚に対する刺激があり、また消毒した表面に腐食や変色を起こす可能性があります。
室内の床面上のダストは、歩行やドアの開閉や掃除などの人の活動によって再飛散(巻き上げられること)が起こります30)。ダストのサイズ・性状や床面の材質や環境条件によって、再飛散率は大きく異なりますが、金属粒子などのダストの再飛散率は0.000001%–0.1%、カビやバクテリアなどの再飛散率は0.0001%–0.1%とされています30)。再飛散率が高くないためか、ウイルス(バクテリオファージ T4)を用いた試験では、ウイルスが検出された床上を歩いた時に、気中からウイルスは検出されませんでした27)。

【さいごに】
感染者が呼吸・会話・咳・くしゃみなどをすると、ウイルスを含む飛沫が環境中に飛散します。会話や咳で飛散する大きな粒子は、多くの場合2 m以内に床面に沈着しますが、室内の気流によっては5 m程度飛散することもあります。また、飛沫核などの小さな粒子は、沈着せずに数時間もしくはそれ以上室内を漂う可能性もあります。室内空気中からウイルスが除去される経路としては、床面や壁面への沈着、換気による屋外への排出、ウイルスの不活化があります。10 μmを超えるサイズの粒子ではほぼ沈着で除去されますが、数μm以下の粒子では換気と不活化の寄与が大きいと考えられます。室内を漂うエアロゾル上の新型コロナウイルスの不活化の半減期は1.1時間程度という報告があることから、換気をしなければ1時間後でも半分のウイルスは活性を持っている可能性があると考えられます。さらに、日本の一般家屋の日常生活時の換気回数は、春夏で1.2–1.7回/h、秋冬で0.6回/h程度であり、病室などで感染対策として取られる換気回数よりはるかに低いため、室内濃度をより効率的に低減させるためには窓開け換気が推奨されます。ただし、屋外の風向や風速によっては、窓開け換気でも十分な換気量が得られないケースもあると思われます。空気清浄機については、コロナウイルスについての研究はありませんが、ウイルスについては一定の効果が認められているため、有用であると思われますが、換気との併用が望ましいでしょう。マスクについては、感染者からの感染リスク低減に効果があると思われるため、着用が望ましいと考えられますが、それらの研究の整理については、別の機会に譲りたいと思います。また、本稿では対象としませんでしたが、接触感染の防止のために、うがいや手洗いを徹底することが、感染防止の観点からも非常に大事だと考えられます。
※ WHOにおける用語の定義1)
- 接触感染
(contact transmission) 直接接触(direct contact)と間接接触 (indirect contact)による感染(transmission)
- 飛沫感染
(droplet transmission) 主に<1 mの距離で生じる飛沫(droplet)による感染
- 空気感染
(airborne transmission) 飛沫核(droplet nuclei)の飛散・吸入による感染
- 飛沫
(droplet) 5 μmより大きい吸入性エアロゾル
- 飛沫核
(droplet nuclei) 5 μmより小さい吸入性エアロゾルで飛沫が乾燥した吸入性エアロゾル残渣(residue of dried respiratory aerosols)
- 感染性吸入性エアロゾル
(infectious respiratory aerosols) 吸入可能なサイズの感染性の飛沫と飛沫核
【謝辞】本稿は、公開に先駆けて、室内環境学会学術委員会によりコメントをいただき、修正いたしました。学術委員会の川上裕司先生(株式会社エフシージー総合研究所)、清水一男先生(静岡大学)、池田四郎先生(株式会社ガステック)、野﨑淳夫先生(東北文化学園大学大学院)、中島大介先生(国立研究開発法人国立環境研究所)、北條祥子先生(東北大学大学院歯学研究科)、水越厚史先生(近畿大学医学部)、徳村雅弘先生(静岡県立大学)、高木麻衣先生(国立研究開発法人国立環境研究所)、理事会の関根嘉香先生(東海大学)、山口一先生(大同大学)、鍵直樹先生(東京工業大学)、三宅祐一先生(静岡県立大学)に深く感謝申し上げます。
【引用文献】
- World Health Organization: Infection prevention and control of epidemic- and pandemic-prone acute respiratory infections in health care. Geneva: World Health Organization (2014) https://apps.who.int/iris/bitstream/handle/10665/112656/9789241507134_eng.pdf?sequence=1
- Chan J et al.: A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet, 395: 514–523. (2020)
- Li Q et al.: Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia. The New England Journal of Medicine, 382: 1199–1207. (2020)
- Huang C et al. : Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, 395: 497–506. (2020)
- Ong SWX et al.: Air, Surface Environmental, and Personal Protective Equipment Contamination by Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) From a Symptomatic Patient. JAMA, E1–E3 (2020)
- World Health Organization: Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19) 16-24 February 2020. (2020) https://www.who.int/docs/default-source/coronaviruse/who-china-joint-mission-on-covid-19-final-report.pdf
- Bella J et al.: Review: Rhinoviruses and their ICAM receptors. Journal of Structural Biology, 128: 69–74. (1999)
- Noda T: Native morphology of influenza virions. Frontiers in Microbiology, 3: 269. (2012)
- Chen N et al.: Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet, 395: 507-513. (2020)
- Johnson GR et al.: Modality of human expired aerosol size distributions. Journal of Aerosol Science. 42: 839-851. (2011)
- Lindsley WG et al.: Quantity and Size Distribution of Cough-Generated Aerosol Particles Produced by Influenza Patients During and After Illness. Journal of Occupational and Environmental Hygiene, 9: 443–449. (2012)
- Chia PY et al.: Detection of Air and Surface Contamination by Severe Acute Respiratory Syndrome 1 Coronavirus 2 (SARS-CoV-2) in Hospital Rooms of Infected Patients. (Preprint from BioRXiv) (2020) https://doi.org/10.1101/2020.03.29.20046557
- Liu Y et al.: Aerodynamic Characteristics and RNA Concentration of SARS-CoV-2 Aerosol in Wuhan Hospitals during COVID-19 Outbreak. (Preprint from BioRXiv). (2020) https://doi.org/10.1101/2020.03.08.982637
- Xie X et al.: How far droplets can move in indoor environments – revisiting the Wells evaporation–falling curve. Indoor air. 17: 211–225. (2007)
- Chen C and Zhao B: Some questions on dispersion of human exhaled droplets in ventilation room: answers from numerical investigation. Indoor Air, 20: 95-111. (2010)
- Morawska L et al.: Size distribution and sites of origin of droplets expelled from the human respiratory tract during expiratory activities. Journal of Aerosol Science. 40, 256–269. (2009)
- Nicas M et al.: Toward understanding the risk of secondary airborne infection: emission of respirable pathogens, Journal of Occupational and Environmental Hygiene, 2, 143–154. (2005)
- Yang W and Marr LC: Dynamics of Airborne Influenza A Viruses Indoors and Dependence on Humidity. PlosOne, 6: e21481. (2011)
- van Doremalen N et al.: Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England Journal of Medicine (in print) https://www.nejm.org/doi/pdf/10.1056/NEJMc2004973
- Shinohara N et al.: Distribution and variability of the 24-h average air exchange rates and interzonal flow rates in 26 Japanese residences over 5 seasons. Atmospheric Environment, 45: 3548–3552. (2011)
- Hou J et al.: Air change rates at night in northeast Chinese homes. Building and Environment, 132: 273–281. (2018)
- Xiao Y et al.: Effects of source emission and window opening on winter indoor particle concentrations in the severe cold region of China. Building and Environment, 144: 23–33. (2018)
- Wang J et al.: Numerical investigation of single-sided natural ventilation driven by buoyancy and wind through variable window configurations. Energy and Buildings, 168: 147–164. (2018)
- Adhikari U et al.: A Case Study Evaluating the Risk of Infection from Middle Eastern Respiratory Syndrome Coronavirus (MERS-CoV) in a Hospital Setting Through Bioaerosols. Risk Analysis, 39: 2608–2624. (2019)
- Riley WJ et al.: Indoor particulate matter of outdoor origin: Importance of size-dependent removal mechanisms. Environmental Science & Technology, 36: 200–207. (2002)
- Li, S et al.: Effects of relative humidity and particle hygroscopicity on the initial efficiency and aging characteristics of electret HVAC filter media. Building and Environment, 171: 106669. (2020)
- Kunkel SA et al.: Quantifying the size-resolved dynamics of indoor bioaerosol transport and control. Indoor Air, 27: 977–987. (2017)
- Foarde KK et al.: Q Development of a method for measuring single-pass bioaerosol removal efficiencies of a room air cleaner. Aerosol Science and Technology, 30: 223–234. (1999)
- Chin AWH et al.: Stability of SARS-CoV-2 in different environmental conditions. Lancet microbe, (2020) https://doi.org/10.1016/S2666-5247(20)30003-3
- Qian J et al.: Walking-induced particle resuspension in indoor environments. Atmospheric environment, 89: 464–481. (2014)
大きな粒子では重力沈降により床面に沈着したり移流により壁面に沈着したりすることが多く、小さな粒子では拡散により床面だけでなく天井や壁面や家具などの表面に沈着することが多いとされています。100 μm, 10 μm, 0.1 μmの粒子の床面に沈着する割合は43%–79%、0.6%–18%、2.5%–18%と仮定でき、壁面に沈着する割合は8.7%–47%、51%–86%、51%–89%と仮定できるとしている研究もあります15)。
大きい飛沫は重力沈降により数秒から15秒程度で床面に沈着しますが、小さい粒子はより長時間空気中を漂っています14)。ウイルス(バクテリオファージ T4)の床面への沈着は、大きな大腸菌のケースと違い、咳をした近く(0.5 m)では少なく、3 m離れた位置で高く、5 m離れた地点でも0.5 mの地点より高かったという報告があり27)、感染者から少し離れた場所で床面に沈着する量が多いと思われます。ちなみに、温度21–23°C相対湿度40%の実験室で行った実験では、銅、段ボール紙、ステンレス鋼、プラスチックの表面における新型コロナウイルス(SARS-CoV-2)の不活化の半減期の中央値は、0.77時間、3.5時間、5.6時間、6.8時間とされており、最大では48時間後のステンレス鋼表面(初期値の0.8%)や72時間後のプラスチック表面(初期値の2%)でもウイルスの活性が確認されたとされており19)、沈着後もしばらくは活性を維持していると考えられます。他にも、温度22°C相対湿度65%の実験室において、新型コロナウイルス(SARS-CoV-2)を含む液を表面に滴下したところ、印刷用紙とティッシュペーパでは3時間後まで、木材や布は2日後まで、ガラスや紙幣は4日後まで、ステンレス鋼やプラスチックは7日後まで活性を有していた(初期値の~0.1%)とする報告もあります29)。ただし、これらは実験室内でコントロールされた条件下の試験であり、実環境中では温度・湿度・紫外線の影響をウイルスが受けうることや、ウイルスの活性を調べているがヒトへ感染するかどうかを調べている試験ではない、という点には注意が必要です。実環境における報告では、新型コロナウイルス(SARS-CoV-2)の患者の病室において、ドアノブやベッドレールなどの手の触れるところだけでなく、床や窓や排気ファンなど沈着したと考えられる箇所からもウイルスが検出されています5,12)。室内の床面や各種表面に沈着したウイルスからの接触感染の可能性もあるため、床面やテーブルやドアノブ等の表面について消毒用エタノールや適切に希釈した次亜塩素酸ナトリウム液を使用した殺菌処理を定期的に行うことが必要と考えられます。ただし、次亜塩素酸ナトリウムは、皮膚に対する刺激があり、また消毒した表面に腐食や変色を起こす可能性があります。
室内の床面上のダストは、歩行やドアの開閉や掃除などの人の活動によって再飛散(巻き上げられること)が起こります30)。ダストのサイズ・性状や床面の材質や環境条件によって、再飛散率は大きく異なりますが、金属粒子などのダストの再飛散率は0.000001%–0.1%、カビやバクテリアなどの再飛散率は0.0001%–0.1%とされています30)。再飛散率が高くないためか、ウイルス(バクテリオファージ T4)を用いた試験では、ウイルスが検出された床上を歩いた時に、気中からウイルスは検出されませんでした27)。

大きい飛沫は重力沈降により数秒から15秒程度で床面に沈着しますが、小さい粒子はより長時間空気中を漂っています14)。ウイルス(バクテリオファージ T4)の床面への沈着は、大きな大腸菌のケースと違い、咳をした近く(0.5 m)では少なく、3 m離れた位置で高く、5 m離れた地点でも0.5 mの地点より高かったという報告があり27)、感染者から少し離れた場所で床面に沈着する量が多いと思われます。ちなみに、温度21–23°C相対湿度40%の実験室で行った実験では、銅、段ボール紙、ステンレス鋼、プラスチックの表面における新型コロナウイルス(SARS-CoV-2)の不活化の半減期の中央値は、0.77時間、3.5時間、5.6時間、6.8時間とされており、最大では48時間後のステンレス鋼表面(初期値の0.8%)や72時間後のプラスチック表面(初期値の2%)でもウイルスの活性が確認されたとされており19)、沈着後もしばらくは活性を維持していると考えられます。他にも、温度22°C相対湿度65%の実験室において、新型コロナウイルス(SARS-CoV-2)を含む液を表面に滴下したところ、印刷用紙とティッシュペーパでは3時間後まで、木材や布は2日後まで、ガラスや紙幣は4日後まで、ステンレス鋼やプラスチックは7日後まで活性を有していた(初期値の~0.1%)とする報告もあります29)。ただし、これらは実験室内でコントロールされた条件下の試験であり、実環境中では温度・湿度・紫外線の影響をウイルスが受けうることや、ウイルスの活性を調べているがヒトへ感染するかどうかを調べている試験ではない、という点には注意が必要です。実環境における報告では、新型コロナウイルス(SARS-CoV-2)の患者の病室において、ドアノブやベッドレールなどの手の触れるところだけでなく、床や窓や排気ファンなど沈着したと考えられる箇所からもウイルスが検出されています5,12)。室内の床面や各種表面に沈着したウイルスからの接触感染の可能性もあるため、床面やテーブルやドアノブ等の表面について消毒用エタノールや適切に希釈した次亜塩素酸ナトリウム液を使用した殺菌処理を定期的に行うことが必要と考えられます。ただし、次亜塩素酸ナトリウムは、皮膚に対する刺激があり、また消毒した表面に腐食や変色を起こす可能性があります。
室内の床面上のダストは、歩行やドアの開閉や掃除などの人の活動によって再飛散(巻き上げられること)が起こります30)。ダストのサイズ・性状や床面の材質や環境条件によって、再飛散率は大きく異なりますが、金属粒子などのダストの再飛散率は0.000001%–0.1%、カビやバクテリアなどの再飛散率は0.0001%–0.1%とされています30)。再飛散率が高くないためか、ウイルス(バクテリオファージ T4)を用いた試験では、ウイルスが検出された床上を歩いた時に、気中からウイルスは検出されませんでした27)。

【さいごに】
感染者が呼吸・会話・咳・くしゃみなどをすると、ウイルスを含む飛沫が環境中に飛散します。会話や咳で飛散する大きな粒子は、多くの場合2 m以内に床面に沈着しますが、室内の気流によっては5 m程度飛散することもあります。また、飛沫核などの小さな粒子は、沈着せずに数時間もしくはそれ以上室内を漂う可能性もあります。室内空気中からウイルスが除去される経路としては、床面や壁面への沈着、換気による屋外への排出、ウイルスの不活化があります。10 μmを超えるサイズの粒子ではほぼ沈着で除去されますが、数μm以下の粒子では換気と不活化の寄与が大きいと考えられます。室内を漂うエアロゾル上の新型コロナウイルスの不活化の半減期は1.1時間程度という報告があることから、換気をしなければ1時間後でも半分のウイルスは活性を持っている可能性があると考えられます。さらに、日本の一般家屋の日常生活時の換気回数は、春夏で1.2–1.7回/h、秋冬で0.6回/h程度であり、病室などで感染対策として取られる換気回数よりはるかに低いため、室内濃度をより効率的に低減させるためには窓開け換気が推奨されます。ただし、屋外の風向や風速によっては、窓開け換気でも十分な換気量が得られないケースもあると思われます。空気清浄機については、コロナウイルスについての研究はありませんが、ウイルスについては一定の効果が認められているため、有用であると思われますが、換気との併用が望ましいでしょう。マスクについては、感染者からの感染リスク低減に効果があると思われるため、着用が望ましいと考えられますが、それらの研究の整理については、別の機会に譲りたいと思います。また、本稿では対象としませんでしたが、接触感染の防止のために、うがいや手洗いを徹底することが、感染防止の観点からも非常に大事だと考えられます。
※ WHOにおける用語の定義1)
- 接触感染
(contact transmission) 直接接触(direct contact)と間接接触 (indirect contact)による感染(transmission)
- 飛沫感染
(droplet transmission) 主に<1 mの距離で生じる飛沫(droplet)による感染
- 空気感染
(airborne transmission) 飛沫核(droplet nuclei)の飛散・吸入による感染
- 飛沫
(droplet) 5 μmより大きい吸入性エアロゾル
- 飛沫核
(droplet nuclei) 5 μmより小さい吸入性エアロゾルで飛沫が乾燥した吸入性エアロゾル残渣(residue of dried respiratory aerosols)
- 感染性吸入性エアロゾル
(infectious respiratory aerosols) 吸入可能なサイズの感染性の飛沫と飛沫核
【謝辞】本稿は、公開に先駆けて、室内環境学会学術委員会によりコメントをいただき、修正いたしました。学術委員会の川上裕司先生(株式会社エフシージー総合研究所)、清水一男先生(静岡大学)、池田四郎先生(株式会社ガステック)、野﨑淳夫先生(東北文化学園大学大学院)、中島大介先生(国立研究開発法人国立環境研究所)、北條祥子先生(東北大学大学院歯学研究科)、水越厚史先生(近畿大学医学部)、徳村雅弘先生(静岡県立大学)、高木麻衣先生(国立研究開発法人国立環境研究所)、理事会の関根嘉香先生(東海大学)、山口一先生(大同大学)、鍵直樹先生(東京工業大学)、三宅祐一先生(静岡県立大学)に深く感謝申し上げます。
【引用文献】
- World Health Organization: Infection prevention and control of epidemic- and pandemic-prone acute respiratory infections in health care. Geneva: World Health Organization (2014) https://apps.who.int/iris/bitstream/handle/10665/112656/9789241507134_eng.pdf?sequence=1
- Chan J et al.: A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet, 395: 514–523. (2020)
- Li Q et al.: Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia. The New England Journal of Medicine, 382: 1199–1207. (2020)
- Huang C et al. : Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, 395: 497–506. (2020)
- Ong SWX et al.: Air, Surface Environmental, and Personal Protective Equipment Contamination by Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) From a Symptomatic Patient. JAMA, E1–E3 (2020)
- World Health Organization: Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19) 16-24 February 2020. (2020) https://www.who.int/docs/default-source/coronaviruse/who-china-joint-mission-on-covid-19-final-report.pdf
- Bella J et al.: Review: Rhinoviruses and their ICAM receptors. Journal of Structural Biology, 128: 69–74. (1999)
- Noda T: Native morphology of influenza virions. Frontiers in Microbiology, 3: 269. (2012)
- Chen N et al.: Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet, 395: 507-513. (2020)
- Johnson GR et al.: Modality of human expired aerosol size distributions. Journal of Aerosol Science. 42: 839-851. (2011)
- Lindsley WG et al.: Quantity and Size Distribution of Cough-Generated Aerosol Particles Produced by Influenza Patients During and After Illness. Journal of Occupational and Environmental Hygiene, 9: 443–449. (2012)
- Chia PY et al.: Detection of Air and Surface Contamination by Severe Acute Respiratory Syndrome 1 Coronavirus 2 (SARS-CoV-2) in Hospital Rooms of Infected Patients. (Preprint from BioRXiv) (2020) https://doi.org/10.1101/2020.03.29.20046557
- Liu Y et al.: Aerodynamic Characteristics and RNA Concentration of SARS-CoV-2 Aerosol in Wuhan Hospitals during COVID-19 Outbreak. (Preprint from BioRXiv). (2020) https://doi.org/10.1101/2020.03.08.982637
- Xie X et al.: How far droplets can move in indoor environments – revisiting the Wells evaporation–falling curve. Indoor air. 17: 211–225. (2007)
- Chen C and Zhao B: Some questions on dispersion of human exhaled droplets in ventilation room: answers from numerical investigation. Indoor Air, 20: 95-111. (2010)
- Morawska L et al.: Size distribution and sites of origin of droplets expelled from the human respiratory tract during expiratory activities. Journal of Aerosol Science. 40, 256–269. (2009)
- Nicas M et al.: Toward understanding the risk of secondary airborne infection: emission of respirable pathogens, Journal of Occupational and Environmental Hygiene, 2, 143–154. (2005)
- Yang W and Marr LC: Dynamics of Airborne Influenza A Viruses Indoors and Dependence on Humidity. PlosOne, 6: e21481. (2011)
- van Doremalen N et al.: Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England Journal of Medicine (in print) https://www.nejm.org/doi/pdf/10.1056/NEJMc2004973
- Shinohara N et al.: Distribution and variability of the 24-h average air exchange rates and interzonal flow rates in 26 Japanese residences over 5 seasons. Atmospheric Environment, 45: 3548–3552. (2011)
- Hou J et al.: Air change rates at night in northeast Chinese homes. Building and Environment, 132: 273–281. (2018)
- Xiao Y et al.: Effects of source emission and window opening on winter indoor particle concentrations in the severe cold region of China. Building and Environment, 144: 23–33. (2018)
- Wang J et al.: Numerical investigation of single-sided natural ventilation driven by buoyancy and wind through variable window configurations. Energy and Buildings, 168: 147–164. (2018)
- Adhikari U et al.: A Case Study Evaluating the Risk of Infection from Middle Eastern Respiratory Syndrome Coronavirus (MERS-CoV) in a Hospital Setting Through Bioaerosols. Risk Analysis, 39: 2608–2624. (2019)
- Riley WJ et al.: Indoor particulate matter of outdoor origin: Importance of size-dependent removal mechanisms. Environmental Science & Technology, 36: 200–207. (2002)
- Li, S et al.: Effects of relative humidity and particle hygroscopicity on the initial efficiency and aging characteristics of electret HVAC filter media. Building and Environment, 171: 106669. (2020)
- Kunkel SA et al.: Quantifying the size-resolved dynamics of indoor bioaerosol transport and control. Indoor Air, 27: 977–987. (2017)
- Foarde KK et al.: Q Development of a method for measuring single-pass bioaerosol removal efficiencies of a room air cleaner. Aerosol Science and Technology, 30: 223–234. (1999)
- Chin AWH et al.: Stability of SARS-CoV-2 in different environmental conditions. Lancet microbe, (2020) https://doi.org/10.1016/S2666-5247(20)30003-3
- Qian J et al.: Walking-induced particle resuspension in indoor environments. Atmospheric environment, 89: 464–481. (2014)
感染者が呼吸・会話・咳・くしゃみなどをすると、ウイルスを含む飛沫が環境中に飛散します。会話や咳で飛散する大きな粒子は、多くの場合2 m以内に床面に沈着しますが、室内の気流によっては5 m程度飛散することもあります。また、飛沫核などの小さな粒子は、沈着せずに数時間もしくはそれ以上室内を漂う可能性もあります。室内空気中からウイルスが除去される経路としては、床面や壁面への沈着、換気による屋外への排出、ウイルスの不活化があります。10 μmを超えるサイズの粒子ではほぼ沈着で除去されますが、数μm以下の粒子では換気と不活化の寄与が大きいと考えられます。室内を漂うエアロゾル上の新型コロナウイルスの不活化の半減期は1.1時間程度という報告があることから、換気をしなければ1時間後でも半分のウイルスは活性を持っている可能性があると考えられます。さらに、日本の一般家屋の日常生活時の換気回数は、春夏で1.2–1.7回/h、秋冬で0.6回/h程度であり、病室などで感染対策として取られる換気回数よりはるかに低いため、室内濃度をより効率的に低減させるためには窓開け換気が推奨されます。ただし、屋外の風向や風速によっては、窓開け換気でも十分な換気量が得られないケースもあると思われます。空気清浄機については、コロナウイルスについての研究はありませんが、ウイルスについては一定の効果が認められているため、有用であると思われますが、換気との併用が望ましいでしょう。マスクについては、感染者からの感染リスク低減に効果があると思われるため、着用が望ましいと考えられますが、それらの研究の整理については、別の機会に譲りたいと思います。また、本稿では対象としませんでしたが、接触感染の防止のために、うがいや手洗いを徹底することが、感染防止の観点からも非常に大事だと考えられます。
| ※ WHOにおける用語の定義1) | |
| - 接触感染 (contact transmission) | 直接接触(direct contact)と間接接触 (indirect contact)による感染(transmission) |
| - 飛沫感染 (droplet transmission) | 主に<1 mの距離で生じる飛沫(droplet)による感染 |
| - 空気感染 (airborne transmission) | 飛沫核(droplet nuclei)の飛散・吸入による感染 |
| - 飛沫 (droplet) | 5 μmより大きい吸入性エアロゾル |
| - 飛沫核 (droplet nuclei) | 5 μmより小さい吸入性エアロゾルで飛沫が乾燥した吸入性エアロゾル残渣(residue of dried respiratory aerosols) |
| - 感染性吸入性エアロゾル (infectious respiratory aerosols) | 吸入可能なサイズの感染性の飛沫と飛沫核 |
【謝辞】本稿は、公開に先駆けて、室内環境学会学術委員会によりコメントをいただき、修正いたしました。学術委員会の川上裕司先生(株式会社エフシージー総合研究所)、清水一男先生(静岡大学)、池田四郎先生(株式会社ガステック)、野﨑淳夫先生(東北文化学園大学大学院)、中島大介先生(国立研究開発法人国立環境研究所)、北條祥子先生(東北大学大学院歯学研究科)、水越厚史先生(近畿大学医学部)、徳村雅弘先生(静岡県立大学)、高木麻衣先生(国立研究開発法人国立環境研究所)、理事会の関根嘉香先生(東海大学)、山口一先生(大同大学)、鍵直樹先生(東京工業大学)、三宅祐一先生(静岡県立大学)に深く感謝申し上げます。
【引用文献】
- World Health Organization: Infection prevention and control of epidemic- and pandemic-prone acute respiratory infections in health care. Geneva: World Health Organization (2014) https://apps.who.int/iris/bitstream/handle/10665/112656/9789241507134_eng.pdf?sequence=1
- Chan J et al.: A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet, 395: 514–523. (2020)
- Li Q et al.: Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia. The New England Journal of Medicine, 382: 1199–1207. (2020)
- Huang C et al. : Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, 395: 497–506. (2020)
- Ong SWX et al.: Air, Surface Environmental, and Personal Protective Equipment Contamination by Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) From a Symptomatic Patient. JAMA, E1–E3 (2020)
- World Health Organization: Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19) 16-24 February 2020. (2020) https://www.who.int/docs/default-source/coronaviruse/who-china-joint-mission-on-covid-19-final-report.pdf
- Bella J et al.: Review: Rhinoviruses and their ICAM receptors. Journal of Structural Biology, 128: 69–74. (1999)
- Noda T: Native morphology of influenza virions. Frontiers in Microbiology, 3: 269. (2012)
- Chen N et al.: Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet, 395: 507-513. (2020)
- Johnson GR et al.: Modality of human expired aerosol size distributions. Journal of Aerosol Science. 42: 839-851. (2011)
- Lindsley WG et al.: Quantity and Size Distribution of Cough-Generated Aerosol Particles Produced by Influenza Patients During and After Illness. Journal of Occupational and Environmental Hygiene, 9: 443–449. (2012)
- Chia PY et al.: Detection of Air and Surface Contamination by Severe Acute Respiratory Syndrome 1 Coronavirus 2 (SARS-CoV-2) in Hospital Rooms of Infected Patients. (Preprint from BioRXiv) (2020) https://doi.org/10.1101/2020.03.29.20046557
- Liu Y et al.: Aerodynamic Characteristics and RNA Concentration of SARS-CoV-2 Aerosol in Wuhan Hospitals during COVID-19 Outbreak. (Preprint from BioRXiv). (2020) https://doi.org/10.1101/2020.03.08.982637
- Xie X et al.: How far droplets can move in indoor environments – revisiting the Wells evaporation–falling curve. Indoor air. 17: 211–225. (2007)
- Chen C and Zhao B: Some questions on dispersion of human exhaled droplets in ventilation room: answers from numerical investigation. Indoor Air, 20: 95-111. (2010)
- Morawska L et al.: Size distribution and sites of origin of droplets expelled from the human respiratory tract during expiratory activities. Journal of Aerosol Science. 40, 256–269. (2009)
- Nicas M et al.: Toward understanding the risk of secondary airborne infection: emission of respirable pathogens, Journal of Occupational and Environmental Hygiene, 2, 143–154. (2005)
- Yang W and Marr LC: Dynamics of Airborne Influenza A Viruses Indoors and Dependence on Humidity. PlosOne, 6: e21481. (2011)
- van Doremalen N et al.: Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England Journal of Medicine (in print) https://www.nejm.org/doi/pdf/10.1056/NEJMc2004973
- Shinohara N et al.: Distribution and variability of the 24-h average air exchange rates and interzonal flow rates in 26 Japanese residences over 5 seasons. Atmospheric Environment, 45: 3548–3552. (2011)
- Hou J et al.: Air change rates at night in northeast Chinese homes. Building and Environment, 132: 273–281. (2018)
- Xiao Y et al.: Effects of source emission and window opening on winter indoor particle concentrations in the severe cold region of China. Building and Environment, 144: 23–33. (2018)
- Wang J et al.: Numerical investigation of single-sided natural ventilation driven by buoyancy and wind through variable window configurations. Energy and Buildings, 168: 147–164. (2018)
- Adhikari U et al.: A Case Study Evaluating the Risk of Infection from Middle Eastern Respiratory Syndrome Coronavirus (MERS-CoV) in a Hospital Setting Through Bioaerosols. Risk Analysis, 39: 2608–2624. (2019)
- Riley WJ et al.: Indoor particulate matter of outdoor origin: Importance of size-dependent removal mechanisms. Environmental Science & Technology, 36: 200–207. (2002)
- Li, S et al.: Effects of relative humidity and particle hygroscopicity on the initial efficiency and aging characteristics of electret HVAC filter media. Building and Environment, 171: 106669. (2020)
- Kunkel SA et al.: Quantifying the size-resolved dynamics of indoor bioaerosol transport and control. Indoor Air, 27: 977–987. (2017)
- Foarde KK et al.: Q Development of a method for measuring single-pass bioaerosol removal efficiencies of a room air cleaner. Aerosol Science and Technology, 30: 223–234. (1999)
- Chin AWH et al.: Stability of SARS-CoV-2 in different environmental conditions. Lancet microbe, (2020) https://doi.org/10.1016/S2666-5247(20)30003-3
- Qian J et al.: Walking-induced particle resuspension in indoor environments. Atmospheric environment, 89: 464–481. (2014)
- World Health Organization: Infection prevention and control of epidemic- and pandemic-prone acute respiratory infections in health care. Geneva: World Health Organization (2014) https://apps.who.int/iris/bitstream/handle/10665/112656/9789241507134_eng.pdf?sequence=1
- Chan J et al.: A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet, 395: 514–523. (2020)
- Li Q et al.: Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia. The New England Journal of Medicine, 382: 1199–1207. (2020)
- Huang C et al. : Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, 395: 497–506. (2020)
- Ong SWX et al.: Air, Surface Environmental, and Personal Protective Equipment Contamination by Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) From a Symptomatic Patient. JAMA, E1–E3 (2020)
- World Health Organization: Report of the WHO-China Joint Mission on Coronavirus Disease 2019 (COVID-19) 16-24 February 2020. (2020) https://www.who.int/docs/default-source/coronaviruse/who-china-joint-mission-on-covid-19-final-report.pdf
- Bella J et al.: Review: Rhinoviruses and their ICAM receptors. Journal of Structural Biology, 128: 69–74. (1999)
- Noda T: Native morphology of influenza virions. Frontiers in Microbiology, 3: 269. (2012)
- Chen N et al.: Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet, 395: 507-513. (2020)
- Johnson GR et al.: Modality of human expired aerosol size distributions. Journal of Aerosol Science. 42: 839-851. (2011)
- Lindsley WG et al.: Quantity and Size Distribution of Cough-Generated Aerosol Particles Produced by Influenza Patients During and After Illness. Journal of Occupational and Environmental Hygiene, 9: 443–449. (2012)
- Chia PY et al.: Detection of Air and Surface Contamination by Severe Acute Respiratory Syndrome 1 Coronavirus 2 (SARS-CoV-2) in Hospital Rooms of Infected Patients. (Preprint from BioRXiv) (2020) https://doi.org/10.1101/2020.03.29.20046557
- Liu Y et al.: Aerodynamic Characteristics and RNA Concentration of SARS-CoV-2 Aerosol in Wuhan Hospitals during COVID-19 Outbreak. (Preprint from BioRXiv). (2020) https://doi.org/10.1101/2020.03.08.982637
- Xie X et al.: How far droplets can move in indoor environments – revisiting the Wells evaporation–falling curve. Indoor air. 17: 211–225. (2007)
- Chen C and Zhao B: Some questions on dispersion of human exhaled droplets in ventilation room: answers from numerical investigation. Indoor Air, 20: 95-111. (2010)
- Morawska L et al.: Size distribution and sites of origin of droplets expelled from the human respiratory tract during expiratory activities. Journal of Aerosol Science. 40, 256–269. (2009)
- Nicas M et al.: Toward understanding the risk of secondary airborne infection: emission of respirable pathogens, Journal of Occupational and Environmental Hygiene, 2, 143–154. (2005)
- Yang W and Marr LC: Dynamics of Airborne Influenza A Viruses Indoors and Dependence on Humidity. PlosOne, 6: e21481. (2011)
- van Doremalen N et al.: Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England Journal of Medicine (in print) https://www.nejm.org/doi/pdf/10.1056/NEJMc2004973
- Shinohara N et al.: Distribution and variability of the 24-h average air exchange rates and interzonal flow rates in 26 Japanese residences over 5 seasons. Atmospheric Environment, 45: 3548–3552. (2011)
- Hou J et al.: Air change rates at night in northeast Chinese homes. Building and Environment, 132: 273–281. (2018)
- Xiao Y et al.: Effects of source emission and window opening on winter indoor particle concentrations in the severe cold region of China. Building and Environment, 144: 23–33. (2018)
- Wang J et al.: Numerical investigation of single-sided natural ventilation driven by buoyancy and wind through variable window configurations. Energy and Buildings, 168: 147–164. (2018)
- Adhikari U et al.: A Case Study Evaluating the Risk of Infection from Middle Eastern Respiratory Syndrome Coronavirus (MERS-CoV) in a Hospital Setting Through Bioaerosols. Risk Analysis, 39: 2608–2624. (2019)
- Riley WJ et al.: Indoor particulate matter of outdoor origin: Importance of size-dependent removal mechanisms. Environmental Science & Technology, 36: 200–207. (2002)
- Li, S et al.: Effects of relative humidity and particle hygroscopicity on the initial efficiency and aging characteristics of electret HVAC filter media. Building and Environment, 171: 106669. (2020)
- Kunkel SA et al.: Quantifying the size-resolved dynamics of indoor bioaerosol transport and control. Indoor Air, 27: 977–987. (2017)
- Foarde KK et al.: Q Development of a method for measuring single-pass bioaerosol removal efficiencies of a room air cleaner. Aerosol Science and Technology, 30: 223–234. (1999)
- Chin AWH et al.: Stability of SARS-CoV-2 in different environmental conditions. Lancet microbe, (2020) https://doi.org/10.1016/S2666-5247(20)30003-3
- Qian J et al.: Walking-induced particle resuspension in indoor environments. Atmospheric environment, 89: 464–481. (2014)
